
����Ŀ������������Ԫ��X��Y��Z��Wԭ���������ε�����Yԭ������������Ϊ�����������Ķ�����mΪԪ��Y�ĵ��ʣ�nΪԪ��Z������������ˮ���p��q��r�ֱ�Ϊ��������Ԫ����ɵĶ�Ԫ���������˵����ȷ����

A. ԭ�Ӱ뾶Y<Z<W
B. ����̬�⻯����ȶ���Y>Z>W
C. ����̬�⻯��е�Y>Z
D. X��Z��W����Ԫ�ؿ����γ����ӻ�����
���𰸡�D
������������������Ԫ��X��Y��Z��Wԭ���������ε�����Yԭ������������Ϊ�����������Ķ�����YΪC��mΪԪ��Y�ĵ��ʣ�nΪԪ��Z������������ˮ���nΪN��C��4HNO3=CO2��4NO2��2H2O��p��q��r�ֱ�Ϊ��������Ԫ����ɵĶ�Ԫ������,��X��Y��Z��W����ΪH��C��N��O
A��ͬ����ԭ�Ӱ뾶��С��ԭ�Ӱ뾶Y>Z>W��A����B��ͬ���ڼ���̬�⻯����ȶ���Ӧ����ǿ����B����C��NH3����֮���γ��������̬�⻯��е��Щ����C����D��X��Z��W����Ԫ�ؿ����γ����ӻ�����NH4NO3����D��ȷ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʶ�Ϊ1mol��NaHCO3��Һ��Ba��OH��2��Һ��ϣ���������ʾ�÷�Ӧ�����ӷ���ʽ�ǣ� ��
A.CO32��+Ba2+=BaCO3
B.HCO3��+OH����H2O+CO32��
C.HCO3��+Ba2++OH����H2O+BaCO3
D.2HCO3��+Ba2++OH��=BaCO3+2H2O+CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̷ų��������ǣ� ��
A.Һ������
B.����ˮ��Ӧ
C.̼��Ʒֽ�
D.��ѧ���Ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��һ���¶��£����ݻ�2 L���ܱ������г���3 mol A �����2.5 mol B���壬������Ӧ3A(g)+B(g)![]() xC(g)+2D(g),����5 min��Ӧ��ƽ�⣬����1.0 mol D��ͬʱ���C��ƽ����������Ϊ0.10 mol/(L��min)����
xC(g)+2D(g),����5 min��Ӧ��ƽ�⣬����1.0 mol D��ͬʱ���C��ƽ����������Ϊ0.10 mol/(L��min)����
��A��ƽ����������Ϊ____________��
��B��ƽ��Ũ��Ϊ____________��
��ƽ��ʱB��ת����Ϊ____________��
��2��һ�������£����淴ӦA2(g)+B2(g)![]() 2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊc(A2)=0.5mol��L��1��c(B2)=0.1mol��L��1��c(C)=1.6mol��L��1��
2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊc(A2)=0.5mol��L��1��c(B2)=0.1mol��L��1��c(C)=1.6mol��L��1��
��A2��B2��C�ij�ʼŨ�ȷֱ���a��b��c��ʾ��mol��L��1������a��bӦ����Ĺ�ϵ��________________________��a��ȡֵ��Χ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������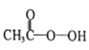 )��һ�ֳ�������������ǿ������,��ѹ�������Ʊ����������������װ�����£�
)��һ�ֳ�������������ǿ������,��ѹ�������Ʊ����������������װ�����£�
����������ƿ�м���һ������������ŨH2SO4�����Һ������������������30%��˫��ˮ��
�ڲ��Ͻ��貢����B�л��Һ���¶�Ϊ20��30��һ��ʱ�䡣
�۽��������ܺͳ����ã�����ƿ���ռ��õ���Ʒ��

��ͬ��Ӧ�������ʵ�������ɹ������Ậ��(%)��ʱ��ı仯����(���±�)����ش�������⣺
��Ӧ����� CH3COOH/H2O2 | ��Ӧʱ��(Сʱ) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(1)C��������ˮ�������_____(��a��b)�����ɹ�������Ļ�ѧ����ʽ��__________��
(2)��Ӧ����ѱ���(CH3COOH/H2O2)��______����Ӧ����ʱ��Լ________(ѡ��1��3��5��7)Сʱ��
(3)Ϊ���ÿ��Ʒ�Ӧ�¶ȣ�Ӧ���ӵĴ�ʩ��________��
(4)�����ʵ��Ƚ�Fe3+��Cu2+�Թ�������Ĵ�Ч�ʡ�
�ɹ�ѡ����Լ��������У�a.����������Һ��b.1mol/L��FeCl3��Һ��c.0.5mol/L��Fe2(SO4)3��Һ��d. 0.5mol/L��CuCl2��Һ��e.1mol/L��CuSO4��Һ��f.��ʱ����g.���������������Ͳ��
��ѡ����Լ���������a��________��f��g(ѡ����ţ�ʵ�鷽����____________��
(5)��Ʒ�����ⶨ��
ȡ2.00mL������������ϡ�ͳ�100mL������ȡ��5.00mL���μ�����KMnO4��Һ��ǡ�÷ۺ�ɫ���Գ�ȥ����H2O2������10mL10%KI��Һ�ͼ��ε�����Һ��ҡ�ȣ���0.1000mol/L��Na2S2O3��Һ�ﵽ���յ�(��Ӧ����ʽΪ2Na2S2O3+I2=Na2S4O6+2NaI)��������13.20mL��Na2S2O3��Һ������Ʒ�й�����������ʵ���Ũ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.���ӻ�������һ�������Ǽ��Թ��ۼ�
B.ԭ�Ӿ�����۵�һ��������������
C.��������Ķѻ���ʽ�Ŀռ���������͵���Po
D.���ɾ��������һ�����л�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����ơ���������ͭ�������ķ�Ӧ������ȷ���ǣ� ��
A. ����������ȼ�գ�����Ϊ����������
B. ����������ױ������������������ܵ������ﱣ��Ĥ
C. �Ƴ����º�������Ӧ�����ɵ���ɫ�Ĺ�������
D. ͭ�����ڼ��ȵ������º�������Ӧ����������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ���л�����ԭ�ϡ�ij����С���Ա�ϩ�Ͳ����Ϊԭ�Ϻϳɲ���һ��߷���ҩ��J���������£�

��֪���ٲ��Գƽṹ��ϩ����H2O��H2SO4�ȼӳ�ʱ���������¹��ɣ�
![]()
��R-CN ![]() R-COOH��R������
R-COOH��R������
��G�����ں˴Ź�������������壬F��G�����ʵ�����Ϊl��1��Ӧ����H��
�ش��������⣺
(1)CH2=CH��CH������A�ķ�Ӧ����Ϊ_________����B����C�Ļ�ѧ����ʽΪ________________
(2)��E����F�ķ�Ӧ����Ϊ______________��F�Ļ�ѧ������_________________��
(3)��F����H�Ļ�ѧ����ʽΪ_____________��
(4)J��NaOH��Һ��������ȫˮ������ò����и߷��ӻ�����Ľṹ��ʽΪ______________��
(5)��֪���л���K(C8H8O2)�벼��һ�Ϊͬϵ�K��ͬ���칹���У����ܷ���������Ӧ��������FeCl3��Һ��Ӧ�Ĺ���________��(���������칹)��
(6)��֪��RCH===CHCH3![]() RCH===CHCHO���Ա�ϩΪԭ��(���Լ���ѡ)������Ʊ�������(
RCH===CHCHO���Ա�ϩΪԭ��(���Լ���ѡ)������Ʊ�������(![]() )�ĺϳ�·��______________��
)�ĺϳ�·��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥFeCl2��Һ��FeCl3��CuCl2���ʿ�ѡ��
A. NaOH B. Cl2ˮ C. Fe�� D. Mg��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com