
| 31 |
| 62 |
| 39 |
| 78 |
| n |
| V |
| 31 |
| 62 |
| 39 |
| 78 |
| 4.6g×80 |
| 46 |
| 4.6g×2 |
| 46 |
| 8g |
| 4.6g+bg-0.2g |
| 11.2L |
| 22.4L/mol |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
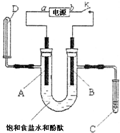 某实验兴趣小组用碳棒和铁棒,利用右图所示装置进行电解食盐水并检验其生成产物的实验,当图中开关k闭合片刻后,试填空:
某实验兴趣小组用碳棒和铁棒,利用右图所示装置进行电解食盐水并检验其生成产物的实验,当图中开关k闭合片刻后,试填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:Al2O3>Al |
| B、热稳定性NaHCO3>Na2CO3 |
| C、酸性:H2CO3>H2SiO3 |
| D、氧化性:Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
A、有
| ||
B、有
| ||
C、有
| ||
D、有
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是指物质所含的粒子个数,它是物质的数量单位 |
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 |
| C、0.012kgC原子中的原子数为1mol |
| D、在标准状况下,CH4与CO2混合物22.4L,所含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com