
【题目】铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________

(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①写出滴定选用的指示剂________,滴定终点观察到的现象_______________________。
②溶液Ⅰ中铁元素的总含量为__________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
【答案】 略 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 略 淀粉 滴加最后一滴标准液溶液蓝色消失且半分钟不恢复 5.6 偏高
【解析】(1) H2O的电子式为:![]() ;(2) NaClO3在酸性条件下将Fe2+氧化生成Fe3+的离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;(4) ①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;滴加最后一滴标准液溶液蓝色消失且半分钟不恢复说明是终点,②若滴定前溶液中H2O2没有除尽,过量的H2O2氧化KI得到I2,根据关系式2Fe3+~I2,I2的量增大使所测定的铁元素的含量偏高。
;(2) NaClO3在酸性条件下将Fe2+氧化生成Fe3+的离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;(3)KNO3和KOH的混合物,写出其与Fe2O3加热共融制得K2FeO4,则缺项中有一种为K2FeO4,K2FeO4中铁元素化合价为+6,则铁离子从+3价变为+6价,化合价升高3价,化合价至少升高3×2=6价;KNO3中N元素从+5降为KNO2中的+3价,化合价降低2价,则化合价最小公倍数为6,所以氧化铁的系数为1,KNO3的系数为3,然后根据质量守恒定律配平,配平后的方程式为:Fe2O3+3KNO3+2KOH=K2FeO4+3KNO2+H2O;(4) ①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;滴加最后一滴标准液溶液蓝色消失且半分钟不恢复说明是终点,②若滴定前溶液中H2O2没有除尽,过量的H2O2氧化KI得到I2,根据关系式2Fe3+~I2,I2的量增大使所测定的铁元素的含量偏高。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2H2O。下列叙述中不正确的是:( )
Cd(OH)2+2H2O。下列叙述中不正确的是:( )
A. 该电池放电的时候,负极材料是Cd
B. 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化
C. 充电时,阴极附近pH增大
D. 充电时,阳极反应是Cd(OH)2+2e-= Cd + 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列叙述中正确的是( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.24g金属镁变为镁离子时失去的电子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量的说法正确的是
A.酸碱中和是放热反应
B.炭在氧气中燃烧属于吸热反应
C.化学键的形成需吸收能量
D.化学反应过程中,化学能一定转化成热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:TiO2→TiCl4![]() ,已知:①C(s)+O2(g)=CO2(g) △H1
,已知:①C(s)+O2(g)=CO2(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H为
A. △H3+2△H1+2△H2 B. △H3+2△H1+△H2
C. △H3+2△H1-△H2 D. △H3+2△H1-2△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,—定能使化学反应速率加快
B. 己知 Ni(CO)4(g)=Ni(s)+4CO(g) △H=QkJ/mol,则 Ni(s) +4CO(g)=Ni(CO)4(g) △H=-QkJ/mol
C. 500°C、30 MPa下, 0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g)![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D. 己知两个平衡体系:2NiO(s)![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g)![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
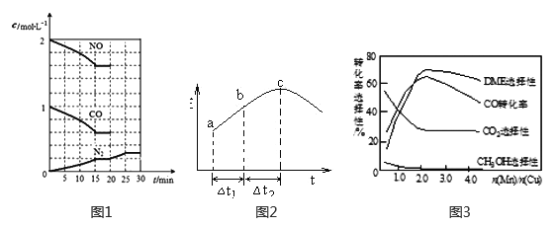
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图错误的是
A | B | C | D |
将二氧化硫通入到一定量饱和氯水中 | 将盐酸滴入到NaHCO3和Na2CO3混合溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com