
| 7 |
| 2 |
| 5 |
| 2 |
| 9 |
| 2 |
| 7 |
| 2 |
| 5 |
| 2 |
| 9 |
| 2 |
|
| 13 |
| 26 |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
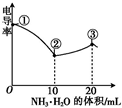 电导率是衡量电解质溶液导电能力大小的物理量.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1 的HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1 的HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A、①点溶液中:c(H+)=0.200 mol?L-1 |
| B、溶液温度:①>③>② |
| C、③点溶液中:c(Cl-)>c(CH3COO-) |
| D、③点后因离子数目减少使溶液的电导率略降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa固体 |
| B、水 |
| C、K2SO4溶液 |
| D、CuSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B、在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C、在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
D、某基态原子错误的核外电子排布图为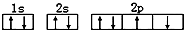 该排布图违背了泡利原理 该排布图违背了泡利原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 原子最外层电子数和电子层数相等 |
| B | 原子的最外层电子数是内层电子总数的2倍 |
| C | 元素主要化合价为-2,原子半径为66pm |
| D | 与A同主族,最高价氧化物对应的水化物易溶于水 |
| E | 原子半径为104pm,所在主族序数与所在周期序数之差为3 |
| F | 单质为有色的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com