
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、NA个氯气分子与NA个氢气分子的质量比等于35.5:1 |
| B、在常温常压下,11.2 L氯气含有分子数为0.5 NA |
| C、与7.8 g Na2O2完全反应时,消耗H2O的分子数为0.2 NA |
| D、1 L 0.5 mol?L-1硝酸钡溶液中所含NO3-数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体析出规则是晶格能高的晶体最后析出 |
| B、铜型和钾型都是密置层堆积方式 |
| C、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高 |
| D、在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
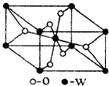 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.查看答案和解析>>
科目:高中化学 来源: 题型:
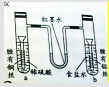 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c(OH-)?c(N
| ||
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |
| c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com