
| 元素 | 有关信息 |
| A | 原子最外层电子数和电子层数相等 |
| B | 原子的最外层电子数是内层电子总数的2倍 |
| C | 元素主要化合价为-2,原子半径为66pm |
| D | 与A同主族,最高价氧化物对应的水化物易溶于水 |
| E | 原子半径为104pm,所在主族序数与所在周期序数之差为3 |
| F | 单质为有色的气体 |
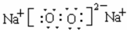 ,为离子化合物,属于离子晶体,
,为离子化合物,属于离子晶体,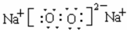 ;离子晶体;
;离子晶体;
| ||
| ||
| ||
| ||


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
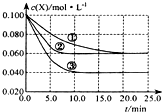 溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )| A、前5min实验③的平均反应速率最快 |
| B、条件②的反应最先达到平衡 |
| C、②与①比较可能是压强更大 |
| D、该反应的正反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
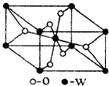 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.查看答案和解析>>
科目:高中化学 来源: 题型:
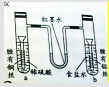 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
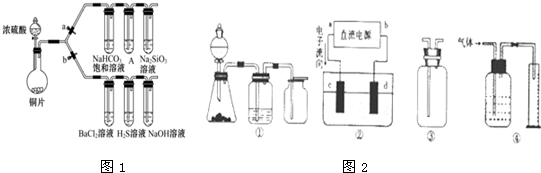
| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com