
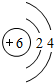 ;
;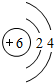 ;极性;非极性.
;极性;非极性.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
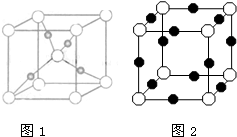 生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源: 题型:
144 62 |
150 62 |
A、
| ||||
B、
| ||||
C、
| ||||
D、据
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
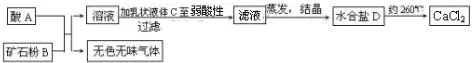
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2溶液 |
| B、饱和Na2CO3溶液 |
| C、Ca(ClO)2溶液 |
| D、Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
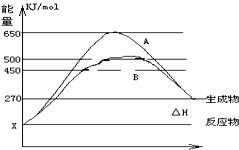 (1)已知:Fe(s)+
(1)已知:Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷 | B、乙烯 | C、丁烷 | D、苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com