


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温常压下,48gO2和48g O3 含有的氧原子数均为3NA |
| B、1mol?L-1 NaCl溶液中含有Na+的个数为NA |
| C、22.4L N2所含分子数为NA |
| D、标准状况下,22.4 L的水中含有NA个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素 原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
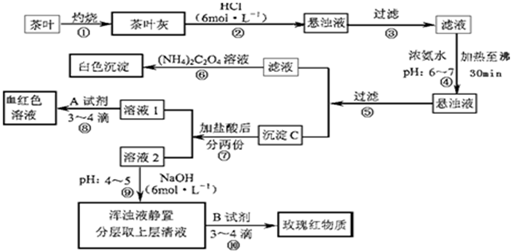
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com