
【题目】实验室需要0.10mol/L的硫酸950mL,某同学欲用密度为![]() 、溶质的质量分数为98%的浓硫酸进行配制。试回答:
、溶质的质量分数为98%的浓硫酸进行配制。试回答:
(1)需选用________容量瓶(填序号)。
A. 50 mL B. 100 mL C. 250 mL D. 1000 mL
(2)需量取98%浓硫酸的体积为_______mL。
(3)若提供如下仪器:
A. 量筒 B. 托盘天平 C. 玻璃棒 D. 容量瓶 E. 胶头滴管 F. 烧杯
完成该实验需选用哪些仪器?请按使用的先后顺序将仪器标号填在横线上:__________________。
(4)下列操作会使所配制的溶液物质的量浓度一定偏低的是_________。
A. 容量瓶洗净后未经干燥处理
B. 向容量瓶转移溶液时,有少量液体溅出
C. 量取浓硫酸时,仰视刻度线
D. 未洗涤烧杯玻璃棒
(5)下列关于容量瓶的使用方法中,正确的是_________(填序号)。
A. 使用前要检验是否漏水 B. 在容量瓶中直接溶解固体或稀释液体
C. 溶液未经冷却即注入容量瓶中 D. 向容量瓶中转移溶液要用玻璃棒引流
【答案】 D 5.4 AFCDE BD AD
【解析】试题分析:本题考查物质的量浓度溶液的配制。
(1)需要配制950mL0.10mol/L硫酸溶液,根据“大而近”的原则,应选用1000mL的容量瓶,答案选D。
(2)根据稀释前后溶质物质的量不变列式,1.84g/cm3V(浓H2SO4)![]() 98%
98%![]() 98g/mol=0.10mol/L
98g/mol=0.10mol/L![]() 1L,解得V(浓H2SO4)=5.4mL。
1L,解得V(浓H2SO4)=5.4mL。
(3)由浓溶液配制一定体积物质的量浓度溶液的实验步骤为:计算→量取→稀释→冷却→转移→洗涤→初步振荡→定容→摇匀→装瓶贴标签,则按使用的先后顺序使用的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,答案为AFCDE。
(4)根据公式cB=![]() 。A项,容量瓶洗净后未经干燥处理,对所配溶液浓度无影响;B项,向容量瓶转移溶液时,有少量液体溅出,溶质物质的量偏小,所配溶液浓度偏低;C项,量取浓硫酸时,仰视刻度线,溶质物质的量偏大,所配溶液浓度偏高;D项,未洗涤烧杯玻璃棒,溶质物质的量偏小,所配溶液浓度偏低;使所配溶液浓度偏低的是BD。
。A项,容量瓶洗净后未经干燥处理,对所配溶液浓度无影响;B项,向容量瓶转移溶液时,有少量液体溅出,溶质物质的量偏小,所配溶液浓度偏低;C项,量取浓硫酸时,仰视刻度线,溶质物质的量偏大,所配溶液浓度偏高;D项,未洗涤烧杯玻璃棒,溶质物质的量偏小,所配溶液浓度偏低;使所配溶液浓度偏低的是BD。
(5)A项,容量瓶使用前要检验是否漏水,正确;B项,容量瓶上有温度、容量和刻度线,不能在容量瓶中直接溶解固体或稀释液体,应先在烧杯中溶解固体或稀释液体并冷却至室温后转移入容量瓶中,错误;C项,物质溶解都有热效应,容量瓶上有温度,溶液经冷却后才能注入容量瓶中,未经冷却即注入容量瓶中会引起实验误差,错误;D项,向容量瓶中转移溶液要用玻璃棒引流,防止液滴外洒,正确;答案选AD。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用苯萃取溴水中的溴时,将溴的苯溶液从下口放出
B. NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即可停止加热
C. 蒸馏操作时,应该将温度计的水银球插入液面以下
D. 氧化钙中混有少量碳酸钙,可用盐酸除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X,Y,Z,W的原子序数依次增大,四种元素同周期,X的金属性再同周期元素中最强,Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位,W的最高价氧化物的水化物的化学式为HnWO2n+2 , 下列说法正确的是( )
A.简单离子半径:X<Y<W
B.Y,Z两种元素的氧化物均具有两性
C.X,W分别形成的氢化物中所含化学键种类相同
D.Z,W形成化合物的电子式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 滴入HNO3同时测定pH至溶液呈中性 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | CO2 | CO | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A. ①② B. ②③④ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M( ![]() )是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).
)是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去). 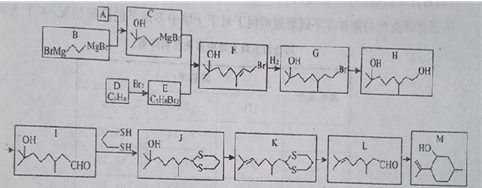
已知:①相同条件下,A的密度是H2的37倍;
② 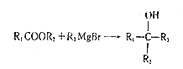
③R1MgBr+R2Br→R1﹣R2(﹣R均代表烃基)
请回答:
(1)A中官能团的名称为;D的化学名称为;E的反式结构简式为 .
(2)F→G,J→K的反应类型分别为、 .
(3)G→H的化学方程式为(注明反应条件).
(4)同时满足下列条件的M的同分异构体有种(不考虑立体异构);
①六元环上连接2个取代基 ②能发生银镜反应
其中核磁共振极谱有8个吸收峰,且峰面积之比为l:l:1:2:2:3:4:4的为(写出其中任意一种的结构简式).
(5)结合题中信息和所学知识,设计一条由A和B为起始原料,发生1,4一加聚反应制备 ![]() 的合成路线(无机试剂任选).
的合成路线(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列五个反应
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
E.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
上述反应中氯元素只被氧化的是_____________,(填字母,下同)只被还原的是_____________,部分被氧化的是_____________,C中被氧化与被还原的物质的量之比为_____________。
(2)在反应4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化产物与还原产物的物质的量之比为___________,生成56gN2转移的电子___________mol。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反应中,若产生2mol N2,转移电子数为_________(用NA表示阿伏加德罗常数);用“双线桥”表示反应中电子转移,化合价的变化,反应类型:______________。
(4)将等质量的两份镁、铝合金分别投入足量的NaOH和HCl中,在相同的情况下测得生成气体的体积之比为1:2,求合金中镁、铝的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,有关该电池的说法正确的( )
2PbSO4+2H2O,有关该电池的说法正确的( )
A.放电时,电解质溶液的pH不断降低且正负极均有PbSO4 生成
B.放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4
C.充电时,阳极反应:PbSO4+2e﹣=Pb+SO42﹣
D.充电时,铅蓄电池的负极与外接电源的负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com