
【题目】某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO42-、Clˉ、CO32-和HCO3-离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸):①向溶液中滴加少量Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1AgNO3溶液,有白色沉淀生成。下列说法不正确的是
A.溶液A中不存在Mg2+、CO32-和HCO3-,不能确定Na+的存在
B.溶液A中存在Fe2+与Cu2+中的一种或两种
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中一定存在H+、SO42-和Clˉ
【答案】A
【解析】
溶液呈绿色,则一定含有![]() 与
与![]() 中的一种或两种,故
中的一种或两种,故![]() 和
和![]() 不能大量存在;①向溶液中滴加
不能大量存在;①向溶液中滴加![]() 溶液,过滤,得到不溶于酸的白色沉淀,则溶液中含有
溶液,过滤,得到不溶于酸的白色沉淀,则溶液中含有![]() ,还有绿色滤液B,则溶液中含有大量
,还有绿色滤液B,则溶液中含有大量![]() ,因氢氧化钡不足,则不能确定是否含有
,因氢氧化钡不足,则不能确定是否含有![]() ;②取滤液B,先用
;②取滤液B,先用![]() 酸化,再滴加0.001mol/L
酸化,再滴加0.001mol/L![]() 溶液,有白色沉淀生成,则溶液中一定存在
溶液,有白色沉淀生成,则溶液中一定存在![]() ,不能确定
,不能确定![]() 是否存在。
是否存在。
A.反应①得到绿色溶液,说明溶液呈酸性,因氢氧化钡不足,则不能确定是否含有![]() ,A错误;
,A错误;
B.因溶液呈绿色,则一定含有![]() 与
与![]() 中的一种或两种,B正确;
中的一种或两种,B正确;
C.因溶液中不存在![]() ,加入硝酸银,不会生成
,加入硝酸银,不会生成![]() ,且
,且![]() 是能溶于硝酸的,故沉淀中不可能含有
是能溶于硝酸的,故沉淀中不可能含有![]() ,故C正确;
,故C正确;
D.由以上分析可知溶液A中一定存在![]() 、
、![]() 和
和![]() ,故D正确;
,故D正确;
答案选A。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:
① HCOOCH3 ② CH3COOH ③ CH3—CH=CH2 ④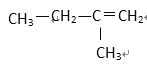 ⑤
⑤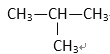
(1) 其中符合通式CnH2n+2的是________ ( 填序号,下同 ), 与 ①互为同分异构体的是_________,与 ③ 互为同系物的是___________
(2) 用系统命名法给 ⑤ 命名,其名称为 _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
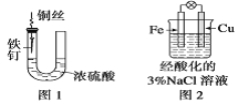

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。
![]()
图中①、②、③可能是( )
A.NH4NO3、(NH4)2SO4、CH3COONa
B.(NH4)2SO4、NH4Cl、C6H5ONa
C.(NH4)2SO4、NH4NO3、Na2CO3
D.(NH4)2SO4、NH4NO3、CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硝酸反应的方程式为:![]()
(1)在该反应中,被还原的元素是_______,氧化产物是_______。
(2)在方程式标出电子转移的方向和数目_______。
(3)若有32g铜参与反应,被还原的硝酸有_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )

A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和目的或结论的说法正确的是( )
选项 | 操作 | 目的或结论 |
A | 将Fe(NO3)2晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变化 | 检验Fe(NO3)2样品是否已被氧化而变质 |
B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物1-2min | 主要目的是去除溶液中的氧气,避免氧气氧化碘离子 |
C | 在试管中依次加入2mL浓硫酸、3mL乙醇和2mL乙酸,用酒精灯缓慢加热 | 制备乙酸乙酯 |
D | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分震荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com