
【题目】某学生用如图装置研究原电池原理,下列有关说法错误的是( )

A.图(3)中Zn片增重质量与Cu片减轻质量的比为65∶64
B.图(2)中,电子经溶液由铜片流向锌片
C.图(1)中铜片上没有气体产生
D.图(2)与图(3)中正极生成物的质量比为1∶32时,Zn片减轻的质量相等
【答案】AB
【解析】
A.图(3)是原电池装置,锌做负极失电子生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,锌电极减轻,铜电极增重,故A错误;
B.图(2)是原电池装置,锌做负极,铜做正极,电子只能在金属导体中传递移动,不能再溶液中移动,故B错误;
C.图(1) 是化学腐蚀,锌和稀硫酸发生反应生成氢气,铜和稀硫酸不反应,图1中铜棒上没有气体产生,故C正确;
D.图(2)与图(3)中电极反应负极Zn-2e- = Zn2+,图2中正极上电极反应2H+ +2e- = H2↑,图3中正极电极反应为Cu2++2e-=Cu,正极生成物质质量比为1:32时,则正极生成物的物质的量之比为1:1,依据电子守恒计算两个原电池中电子转移相同,所以反应的锌的质量相同,故D正确;
答案选AB。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常见有机反应类型有:①取代反应、②加成反应、③消去反应、④酯化反应、⑤加聚反应、⑥氧化反应、⑦还原反应,其中能在有机物中引入羟基的反应类型是
A. ①②③B. ①②⑦C. ⑤⑥⑦D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. KClO3+6HC1=KCl+3C12↑+3H2O 中,生成13.44L (标准状况) C12转移电子数为1.2 NA
B. 标准状况下,22.4LC12通入足量水中转移电子数为NA
C. 足量的MnO2与一定量的浓盐酸反应得到1mol Cl2,若向反应后的溶液中加入足量的AgNO3,则生成AgC1的物质的量为2 mol
D. 5.6g Fe 与一定量的稀硝酸反应,转移电子数可能为0.26 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是( )
①仅用试管、胶头滴管、溴水、KI淀粉溶液就可比较Br2与I2的氧化性的强弱
②利用烧杯、玻璃棒、胶头滴管、分液漏斗及溴水和CCl4能除去NaBr溶液中的少量NaI
③海水提溴与海带提碘均涉及氧化还原反应
④制备粗硅的反应为C+SiO2![]() Si+CO2↑
Si+CO2↑
⑤SiO2与Al2O3均能与强碱溶液反应,所以均为酸性氧化物
⑥光导纤维的成分主要是Si
A.①②③B.②③④
C.②④⑥D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨或铵盐的说法不正确的是
A. 可用湿润的红色石蕊试纸检验氨气
B. 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl)
C. NH3属于弱电解质
D. 常温时,0.1 mol·L1NH4Cl溶液加水稀释,![]() 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃条件下向10.00 mL 0.1 mol·L-1HCOOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如下图所示(忽略温度变化)。下列说法中不正确的是( )
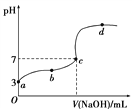
A. a点表示的溶液中c(HCOO-)约为10-3 mol·L-1
B. 用25 mL的酸式滴定管量取HCOOH溶液
C. c点NaOH溶液的体积小于10 mL
D. 在a、c间任一点,溶液中一定都有c(Na+)>c(HCOO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中,不断通入HCl气体
溶液中,不断通入HCl气体![]() 忽略溶液体积变化
忽略溶液体积变化![]() ,得到
,得到![]() 和
和![]() 与pH的变化关系如图所示,则下列说法不正确的是
与pH的变化关系如图所示,则下列说法不正确的是![]()
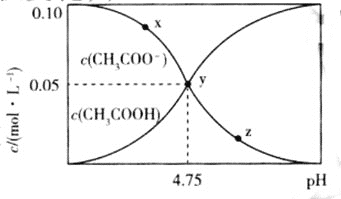
A.溶液中水的电离程度:![]()
B.在y点时,通入的HCl气体在标准状况下的体积为![]()
C.随着HCl的通入,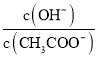 不断减小
不断减小
D.该温度下,![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是
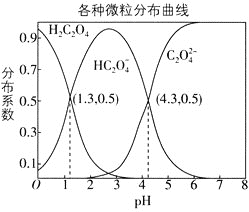
A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。某温度下,在容积为1L的密闭容器中充入1mol
。某温度下,在容积为1L的密闭容器中充入1mol![]() 和
和![]()
![]() ,在一定条件下反应,测得
,在一定条件下反应,测得![]() 、
、![]() 的物质的量随时间的变化关系如图所示。下列说法正确的是
的物质的量随时间的变化关系如图所示。下列说法正确的是
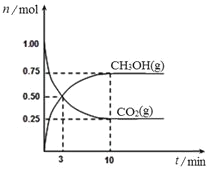
A.从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]()
![]()
B.此温度下,该反应的平衡常数为![]()
C.缩小体积,既能增大反应速率,又能提高![]() 的转化率
的转化率
D.欲增大平衡状态时![]() ,可采用升高温度的方法
,可采用升高温度的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com