
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是
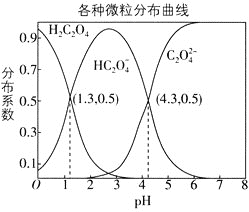
A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:![]()
![]() 。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。

(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
(2)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是____________________________________ (用文字表达);
(3)若要准确测定NO2相对分子质量,应采取的有效措施是_________ (填字母序号)
A.升高温度,降低压强 B.降低温度,升高压强
C.降低温度,降低压强 D.升高温度,升高压强
(4)根据图像,计算反应![]() 在该温度下的平衡常数K=________
在该温度下的平衡常数K=________
(5)现用3.2gCu与足量的浓HNO3反应,制得1.68 L N2O4和NO2的混合气体(体积以标况折算),则含有NO2的物质的量为____ ,化学反应__________ (填向逆方向进行、向正方向进行、已达平衡)(温度不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置研究原电池原理,下列有关说法错误的是( )

A.图(3)中Zn片增重质量与Cu片减轻质量的比为65∶64
B.图(2)中,电子经溶液由铜片流向锌片
C.图(1)中铜片上没有气体产生
D.图(2)与图(3)中正极生成物的质量比为1∶32时,Zn片减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学问题可用相似的示意图来表示。下列说法不正确的是![]()
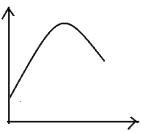
选项 | 横坐标 | 纵坐标 | 研究对象 |
A | 反应时间 | 溶液温度 | 足量镁条放在 |
B | 反应温度 | 反应速率 | 酶催化反应 |
C | 盐酸体积 | 沉淀质量 |
|
D | 反应过程 | 能量 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.0100mol/L苯酚(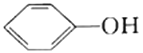 )溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
)溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
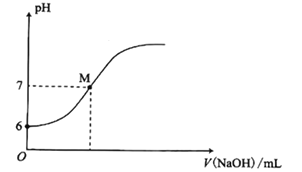
A. 25℃时,苯酚的电离常数Ka约为1.0×10-4
B. M点时,所加人NaOH溶液的体积大于10mL
C. M点时,溶液中的水不发生电离
D. 加入20mLNaOH溶液时,溶液中c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,![]() 的
的![]() 和
和![]() 的
的![]() 两种碱溶液,起始时的体积均为
两种碱溶液,起始时的体积均为![]() ,分别向两溶液中加水进行稀释,所得曲线如图所示
,分别向两溶液中加水进行稀释,所得曲线如图所示![]() 表示溶液的体积
表示溶液的体积![]() ,
,![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
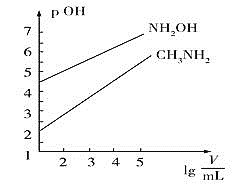
A.![]() 的电离常数
的电离常数![]() 的数量级为
的数量级为![]()
B.用相同浓度的盐酸分别滴定上述两种碱溶液至![]() ,消耗盐酸体积:
,消耗盐酸体积:![]()
C.当两溶液均稀释至![]() 时,溶液中水的电离程度:
时,溶液中水的电离程度:![]()
D.浓度相同的![]() 和
和![]() 的混合溶液中离子浓度大小关系:
的混合溶液中离子浓度大小关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )
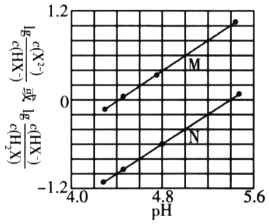
A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL0.2mol·L-1的氢氧化钠溶液,下列说法正确的是( )
A.用托盘天平称取3.8gNaOH固体
B.若其他操作正确,将NaOH固体放在烧杯中溶解后,立即转移至容量瓶中定容,所得溶质物质的量浓度偏大
C.若其他操作正确,定容摇匀后,溶液凹液面最低点低于刻度线,用胶头滴管加水至刻度线,所得溶质物质的量浓度偏大
D.用0.8mol·L-112mLNaOH溶液稀释成480mL即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com