
【题目】已知NO2和N2O4可以相互转化:![]()
![]() 。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。

(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
(2)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是____________________________________ (用文字表达);
(3)若要准确测定NO2相对分子质量,应采取的有效措施是_________ (填字母序号)
A.升高温度,降低压强 B.降低温度,升高压强
C.降低温度,降低压强 D.升高温度,升高压强
(4)根据图像,计算反应![]() 在该温度下的平衡常数K=________
在该温度下的平衡常数K=________
(5)现用3.2gCu与足量的浓HNO3反应,制得1.68 L N2O4和NO2的混合气体(体积以标况折算),则含有NO2的物质的量为____ ,化学反应__________ (填向逆方向进行、向正方向进行、已达平衡)(温度不变)。
【答案】X b和d B 增大NO2的浓度 A 1.1或![]() 0.05mol 向逆方向进行
0.05mol 向逆方向进行
【解析】
(1)由图可知010min时,X表示的生成物的浓度变化量为(0.60.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.60.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,1025min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态;
A、恒温恒容容器中,气体压强之比等于气体物质的量之比,当容器内压强不变时,即气体的物质的量不变,该反应属于气体非等体积反应,因此当容器内混合气体的压强不随时间变化而改变时,反应达到平衡状态,故A不选;
B、容器内混合气体的体积不变,质量不变所以密度不变,因此,密度不能判断平衡,故B选;
C、容器内混合气体的颜色不随时间变化而改变,即NO2浓度不再变化,即该反应达到平衡状态,故C不选;
D、该反应属于气体非等体积反应,未达到平衡状态时,气体的物质的量会变化,气体总质量一定,其平均分子量不变时,即气体物质的量不变,可判断该反应达到平衡状态,故D不选;
(2)由曲线看出25min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度;
(3)若要准确测定NO2相对分子质量,即体系中NO2百分含量越高越准确,即需要改变外界条件使平衡逆向移动,该反应正向为放热反应,升温可使平衡逆向移动,该反应正向为气体体积减小的反应,减小压强,平衡逆向移动,综上所述,可采取措施为:升高温度,降低压强,答案为A;
(4)以10~25min内各物质平衡浓度计算平衡常数,根据图像可知,c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,由此计算K=![]() ;
;
(5)3.2gCu Cu与足量的浓HNO3反应,铜完全反应生成Cu(NO3)2,转移电子的物质的量![]() ×2=0.1mol,HNO3作氧化剂的部分生成NO2、N2O4,N元素化合价降低1,设n(NO2)=xmol、n(N2O4)=ymol,根据得失电子守恒,可列出方程组:
×2=0.1mol,HNO3作氧化剂的部分生成NO2、N2O4,N元素化合价降低1,设n(NO2)=xmol、n(N2O4)=ymol,根据得失电子守恒,可列出方程组:
![]() ,解得
,解得![]() ,即含有NO2的物质的量为0.05mol;浓度熵QC=
,即含有NO2的物质的量为0.05mol;浓度熵QC=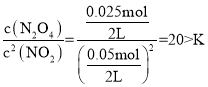 ,则反应向逆方向进行。
,则反应向逆方向进行。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,能大量共存的是( )
![]() 无色溶液中:
无色溶液中:![]()
![]()
![]()
![]()
![]()
![]() 的溶液中:
的溶液中:![]()
![]()
![]()
![]()
![]()
![]() 水电离的
水电离的![]() 浓度为
浓度为![]() 的溶液中:
的溶液中:![]()
![]()
![]()
![]()
![]()
![]() 加入铝粉放出氢气的溶液中:
加入铝粉放出氢气的溶液中:![]()
![]()
![]()
![]()
![]()
![]()
![]() 使甲基橙变红的溶液中:
使甲基橙变红的溶液中:![]()
![]()
![]()
![]()
![]()
![]() 中性溶液中:
中性溶液中:![]()
![]()
![]()
![]()
![]() 能溶解铜粉的溶液:
能溶解铜粉的溶液:![]()
![]()
![]()
![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机反应类型有:①取代反应、②加成反应、③消去反应、④酯化反应、⑤加聚反应、⑥氧化反应、⑦还原反应,其中能在有机物中引入羟基的反应类型是
A. ①②③B. ①②⑦C. ⑤⑥⑦D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是:
A. 在一个氧化还原反应中,氧化剂的氧化性强于氧化产物
B. 在一个氧化还原反应中,还原产物的还原性弱于还原剂
C. amolH2SO4中,含有b个氧原子,则阿伏加德罗常数可以表示为b/4a/mol
D. 配制0.05mol/LNa2CO3溶液90mL,需Na2CO3固体5.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平昌冬奥会“北京8 分钟”主创团队用石墨烯制作了-20℃能发热4 h 的智能服饰; 用铝合金管材和碳纤维制作了高2.35m、重量仅为10kg 的熊猫木偶,向世界展现了新时代的中国形象。下列说法中,不正确的是

A. 石墨烯是能导热的金属材料 B. 铝合金是密度较低的金属材料
C. 碳纤维是耐低温的无机非金属材料 D. 新型材料种类多、用途广
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. KClO3+6HC1=KCl+3C12↑+3H2O 中,生成13.44L (标准状况) C12转移电子数为1.2 NA
B. 标准状况下,22.4LC12通入足量水中转移电子数为NA
C. 足量的MnO2与一定量的浓盐酸反应得到1mol Cl2,若向反应后的溶液中加入足量的AgNO3,则生成AgC1的物质的量为2 mol
D. 5.6g Fe 与一定量的稀硝酸反应,转移电子数可能为0.26 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是( )
①仅用试管、胶头滴管、溴水、KI淀粉溶液就可比较Br2与I2的氧化性的强弱
②利用烧杯、玻璃棒、胶头滴管、分液漏斗及溴水和CCl4能除去NaBr溶液中的少量NaI
③海水提溴与海带提碘均涉及氧化还原反应
④制备粗硅的反应为C+SiO2![]() Si+CO2↑
Si+CO2↑
⑤SiO2与Al2O3均能与强碱溶液反应,所以均为酸性氧化物
⑥光导纤维的成分主要是Si
A.①②③B.②③④
C.②④⑥D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是
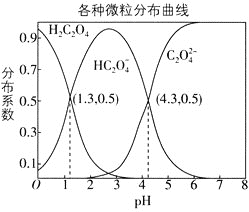
A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com