
| A、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| B、加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- |
| C、含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- |
| D、0.1mol/LFeCl3溶液中:Na+、NH4+、SCN-、SO42- |


科目:高中化学 来源: 题型:
| A、X有三种同位素 |
| B、其中一种同位素的质量为80 |
| C、X2的平均相对分子质量为159 |
| D、质量数为79的同位素的原子百分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂解、煤的气化、海水的提镁都包含化学变化 |
| B、高温条件下杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| C、纯碱可用于生产普通玻璃,也可用纯碱除去物品表面的油污 |
| D、气候环境报告中“PM2.5”就是雾霾,雾霾仅影响能见度,对人体健康没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
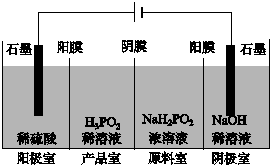 次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):查看答案和解析>>
科目:高中化学 来源: 题型:
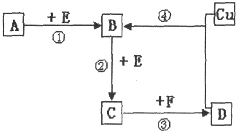 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题: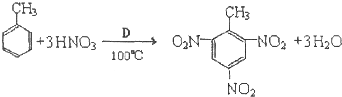
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32-、I- |
| B、pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ |
| D、所含溶质为Na2CO3的溶液:K+、Na+、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
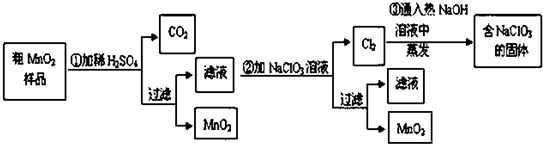
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com