
| A、N2(g)+3H2(g)?2NH3(g)△H<0 |
| B、N2(g)+O2(g)?2NO(g)△H<0 |
| C、C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0 |
| D、2SO2(g)+O2(g)?2SO3(g)△H<0 |
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl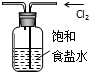 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | ||
| B、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol?L-1 | ||
| C、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | ||
D、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同浓度的同一弱电解质,其电离常数(K)不同 |
| B、温度越高,化学平衡常数一定越大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D、化学平衡发生移动,平衡常数必发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(NO2) |
| c2(NO)c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 |
| B、用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| C、配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| E、Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中 |
| F、将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体氯化钠不导电,所以氯化钠不是电解质 |
| B、氯化氢水溶液能导电,所以氯化氢是电解质 |
| C、CO2溶于水能导电,所以 CO2是电解质 |
| D、铜丝能导电,所以铜是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com