
【题目】对于可逆反应2AB3(g)![]() 2A(g)+3B2(g) △H>0 ,下列图象不正确的是( )
2A(g)+3B2(g) △H>0 ,下列图象不正确的是( )
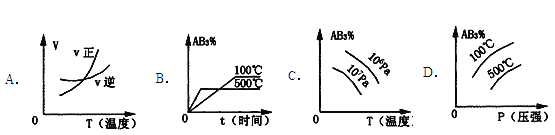
【答案】D
【解析】
试题分析:对于可逆反应2AB3(g)![]() 2A(g)+3B2(g)△H>0,反应吸热,升高温度,正逆反应速率都增大,平衡向正反应方向移动,反应物的化学计量数之和小于生成物的化学计量数之和,增大压强,平衡向逆反应方向移动;A、反应吸热,升高温度,正逆反应速率都增大,但正反应速率增大的倍数比逆反应速率大,平衡向正反应方向移动,A正确;B.反应吸热,升高温度,反应速率增大,平衡向正反应方向移动,AB3的含量降低,B正确;C.升高温度,平衡向正反应方向移动,AB3的含量降低,反应物的化学计量数之和小于生成物的化学计量数之和,增大压强,平衡向逆反应方向移动,AB3的含量增大,C错误;D.升高温度,平衡向正反应方向移动,AB3的含量降低,反应物的化学计量数之和小于生成物的化学计量数之和,增大压强,平衡向逆反应方向移动,AB3的含量增大,D正确,答案选C。
2A(g)+3B2(g)△H>0,反应吸热,升高温度,正逆反应速率都增大,平衡向正反应方向移动,反应物的化学计量数之和小于生成物的化学计量数之和,增大压强,平衡向逆反应方向移动;A、反应吸热,升高温度,正逆反应速率都增大,但正反应速率增大的倍数比逆反应速率大,平衡向正反应方向移动,A正确;B.反应吸热,升高温度,反应速率增大,平衡向正反应方向移动,AB3的含量降低,B正确;C.升高温度,平衡向正反应方向移动,AB3的含量降低,反应物的化学计量数之和小于生成物的化学计量数之和,增大压强,平衡向逆反应方向移动,AB3的含量增大,C错误;D.升高温度,平衡向正反应方向移动,AB3的含量降低,反应物的化学计量数之和小于生成物的化学计量数之和,增大压强,平衡向逆反应方向移动,AB3的含量增大,D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A.X原子可能为第ⅤA族元素
B.Y原子一定为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某混合物的无色透明溶液,可能含有以下离子中的若干种:
Na+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液有沉淀产生,加足量稀硝酸后沉淀部分溶解;
②第二份加足量NaOH溶液充分加热后,收集到气体0.896L(标准状况);
③第三份加足量BaCl2溶液后,过滤后充分干燥得到沉淀6.27g,再经足量稀硝酸洗涤、干燥后,沉淀质量变为2.33g。根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是 ,一定不存在的离子是 ,可能存在的离子是 。
(2)②中发生化学反应的离子方程式为 。
(3)③中生成可溶于稀硝酸的沉淀化学式为 ,物质的量为 mol,该沉淀溶于稀硝酸的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出.
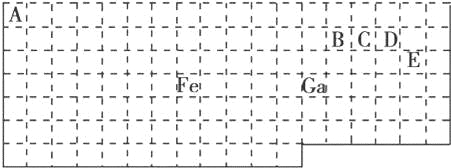
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的 区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为 和 (填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 .B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为 (写2种).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验:
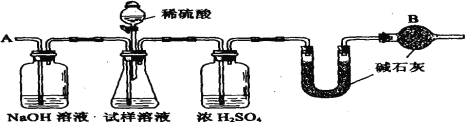
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的重量,得到b g
④从分液漏斗滴入6mol·1-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓慢鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的重量,得到c g
⑦ 重复步骤⑤和⑥的操作一直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种不同的实验方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
①铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
②往FeCl3溶液中加入Fe粉:2Fe3++Fe =3Fe2+
③氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
④氯化铁水解:Fe3+ +3H2O = Fe(OH)3↓+ 3H+
⑤氯化亚铁溶液中加入氯水:Fe2++C12=Fe3++2C1-
⑥钾投入水中:2K+2H2O = 2K++2OH-+H2↑
⑦Na2CO3溶液中通入过量CO2:CO![]() +CO2+H2O = 2HCO
+CO2+H2O = 2HCO![]()
⑧NaHCO3溶液显碱性:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
⑨硫酸铝溶液中加入过量氨水: Al3++3OH—═Al(OH)3↓
⑩烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑
A.①③⑤⑦ B.②④⑥⑧ C.②④⑤⑨ D.②⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离提纯方法选择不正确的是
A | 除去氯化钠溶液中的泥沙 | 过滤 |
B | 用四氯化碳提取溴水中的溴 | 萃取 |
C | 分离乙酸(沸点 118℃ )与乙酸乙酯(沸点 77℃ ) | 分液 |
D | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | 结晶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是 和 。(填化学式)
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕色沉淀,向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为 。
A.SO32-B.SO42- C.CH3COO-D.SiO32-
②A中的化学键类型为
③将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1g)。
④利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
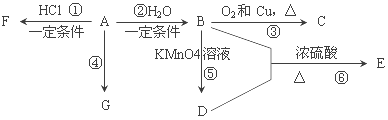
请回答下列问题:
(1)A的官能团的名称是______________________;C的结构简式是______________;
(2)E是一种具有香味的液体,由B+D→的反应方程式为___________,该反应类型是______________;
(4)G是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27°C)进行应急处理.写出由A制F的化学反应方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com