
【题目】现有某混合物的无色透明溶液,可能含有以下离子中的若干种:
Na+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液有沉淀产生,加足量稀硝酸后沉淀部分溶解;
②第二份加足量NaOH溶液充分加热后,收集到气体0.896L(标准状况);
③第三份加足量BaCl2溶液后,过滤后充分干燥得到沉淀6.27g,再经足量稀硝酸洗涤、干燥后,沉淀质量变为2.33g。根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是 ,一定不存在的离子是 ,可能存在的离子是 。
(2)②中发生化学反应的离子方程式为 。
(3)③中生成可溶于稀硝酸的沉淀化学式为 ,物质的量为 mol,该沉淀溶于稀硝酸的离子方程式为 。
【答案】(1)CO32-、SO42-;Mg2+、Ba2+;Cl-;
(2)NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
(3)BaCO3,0.02 ,BaCO3+2H+=Ba2++CO2↑+H2O。
【解析】
试题解析:①加入AgNO3溶液,有沉淀生成,加入硝酸沉淀部分消失,溶液中含有Cl-、CO32-和SO42-至少含有一种;②加入氢氧化钠溶液,加热产生气体,此气体为氨气,溶液中含有NH4+,其物质的量为0.896/22.4mol=0.04mol,③加入BaCl2得到沉淀,加入硝酸沉淀质量减少,一定含有CO32-和SO42-,根据离子共存,一定没有Mg2+和Ba2+,根据质量求出n(SO42-)=2.33/233mol=0.01mol,n(CO32-)=(6.27-2.33)/197mol=0.02mol,根据溶液呈现电中性,阳离子所带电荷物质的量为0.04mol,阴离子所带电荷物质的量0.06mol,因此含有一定含有Na+,(1) CO32-、SO42- ;Mg2+、Ba2+; Cl-;(2) NH4++OH-![]() NH3↑+H2O(3)BaCO3,0.02 ,BaCO3+2H+=Ba2++CO2↑+H2O。
NH3↑+H2O(3)BaCO3,0.02 ,BaCO3+2H+=Ba2++CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数的说法中,正确的是
A.在任何条件下,化学平衡常数都是一个定值
B.化学平衡常数K可以推断一个可逆反应进行的程度
C.化学平衡常数K只与温度、反应物浓度、体系的压强有关
D.当改变反应物的浓度时,化学平衡常数会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
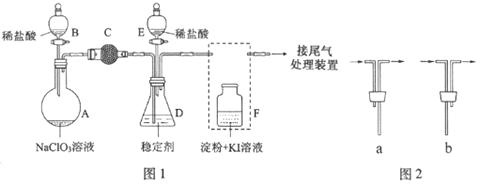
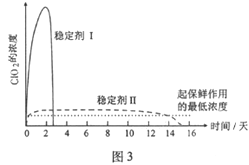
(1)仪器D的名称是_______,安装F中导管时,应选用图2中的___________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是___________,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同质量的锌与稀硫酸反应,欲使反应速率最大,选择下列组合中的反应条件
①锌粒
②锌片
③锌粉
④10%的硫酸
⑤20%的硫酸
⑥98%的硫酸
⑦加热
⑧用冰冷却
⑨不断搅拌
⑩迅速加入锌后静置
A.②⑤⑦⑩ B.①④⑧⑩ C.③⑤⑦⑨ D.③⑥⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大.A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒.
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示).
(2)D元素原子的价电子排布式是 .
(3)C元素的电子排布图为 ;E3+的离子符号为 .
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 .
(5)G元素可能的性质 .
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室用乙酸和异戊醇制备乙酸异戊酯的反应、装置示意图和有关数据如下:
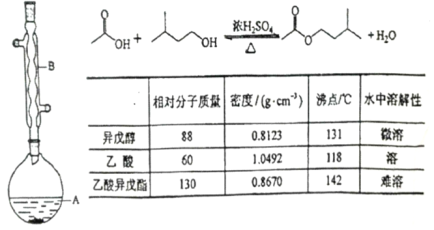
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和23片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4, 固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是 ,作用是 .
(2)碎瓷片的作用是 .
(3)在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是 .
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_________
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(5)实验中加入少量无水MgSO4的目的是 .
(6)本实验的产率是 .a.30% b.40% c.50% d.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
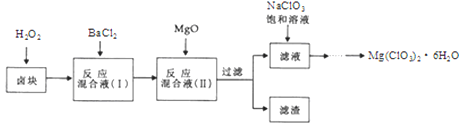
已知:
①.卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②.四种化合物的溶解度(S)随温度(T)变化曲线如图所示。回答下列问题:
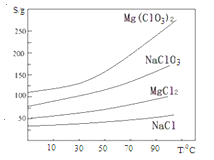
(1).过滤时主要的玻璃仪器有
(2).加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是
(3).加入H2O2溶液的作用是: ;加入MgO的作用是
(4).滤渣的主要成分为 。
(5).向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2 + 2NaClO3 = Mg(ClO3)2↓ + 2NaCl,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6).产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2: 取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-)
②产品中Mg(ClO3)2·6H2O的质量分数为 【Mg(ClO3)2·6H2O的相对分子质量为299,列出表达式即可)】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com