
【题目】下列反应不能发生的是
A. 木炭投入到热的浓硫酸中 B. 木炭投入到热的浓硝酸中
C. 铜片投入到冷的浓硫酸中 D. 铜片投入到冷的浓硝酸中
科目:高中化学 来源: 题型:
【题目】铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子有_________种不同运动状态的电子。
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为________;该配合物中原子Ni的价层电子总数为18,则n=________,该配合物的熔点是170℃,则Ni(CO)n 属于__________
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C=O的键角_______(填“大于”、“等于”或“小于”)乙醇分子中的H—C—O的键角。乙醇和乙醛均极易溶于水,其主要原因是_______________。
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的________空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”)。其晶胞边长为ɑ pm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在在恒容的密闭容器中,能表示反应X (g) + 2Y (g) ![]() 2Z (g)一定达到化学平衡状态的是:
2Z (g)一定达到化学平衡状态的是:
①X、Y、Z的物质的量之比为1:2:2
② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化
④ 单位时间内生成n molZ,同时生成2n molY
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:CO (g) +2H2(g)![]() CH3OH(l) △H=?
CH3OH(l) △H=?
(1)己知CO、H2、CH3OH的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol 则△H=______。
(2)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:CO (g) +2H2(g)![]() CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
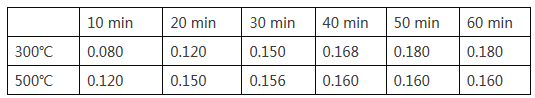
①由上述数据可以判断:T1℃_____T2℃
②T1℃时,0~20minH2的平均反应速率v(H2)=_________。
③该反应T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.改用高效催化剂 B.升高温度 C.缩小容器体积 D.分离出甲醇 E.增加CO的浓度
(3)若保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件___________。
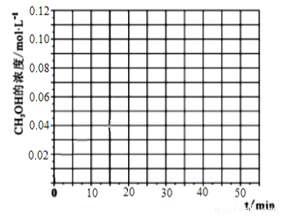
(4)当反应在T1℃达到20min时,控制体积不变,迅速将0.02molCO,0.04molH2,0.18molCH3OH同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出2040min内容器中 H2浓度的变化趋势曲线:___________
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__________;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)已知NaHA水溶液呈碱性。
①用离子方程式及文字表示NaHA水溶液呈碱性的原因__________________。
②在NaHA水溶液中各离子浓度的大小关系是______________。
(2)25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
Ⅱ.(5分)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA -![]() H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是_________(填写字母)。
A.溶液pH=7 B.水的离子积Kw=[c2(OH-)]
C.V=10 D.c(K+)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com