
【题目】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:
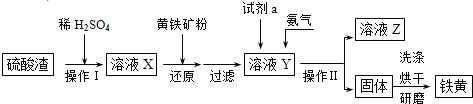
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是___、___。
(2)试剂a最好选用___(供选择使用的有:铝粉、空气、浓HNO3);其作用是___。
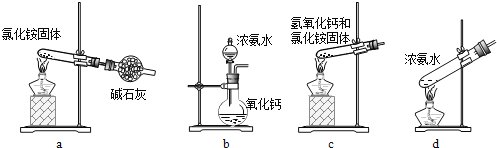
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是___(填序号)。
(4)检验溶液Z中含有NH4+的方法是___。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如图所示。
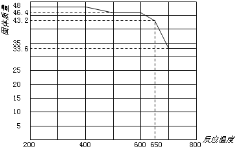
根据图象推断650℃时Fe2O3还原产物的化学式为___,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。___。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
【答案】搅拌加速溶解(或搅拌加速反应) 引流 空气 作氧化剂,将Fe2+氧化为Fe3+ bd 取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+ FeO 取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO
【解析】
(1)操作Ⅰ是利用玻璃棒搅拌加速硫酸渣的溶解,操作Ⅱ是过滤实验,玻璃棒起到引流作用;
(2)依据流程分析,试剂a是用来氧化亚铁离子的,选择试剂时不能引入新的杂质;
(3)a、加热氯化铵分解后生成的氨气和氯化氢会在试管口重新生成氯化铵,不能制得氨气;
b、氨水滴入氧化钙固体,氧化钙会和水反应生成氢氧化钙放热,使一水合氨分解生成氨气;
c、氢氧化钙和氯化铵固体加热时需要试管口略向下倾斜,图中装置加热时会使生成的水倒流到试管底部炸裂试管;
d、加热浓氨水会分解生成氨气,可以制取氨气;
(4)检验溶液Z中含NH4+,可利用铵根离子和氢氧根离子加热反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝;
(5)根据数据进行计算,结合产物进行判断。
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,操作Ⅰ是利用玻璃棒搅拌加速硫酸渣的溶解,操作Ⅱ是过滤实验,玻璃棒起到引流作用;
(2)依据流程分析,试剂a是用来氧化亚铁离子的,选择试剂时不能引入新的杂质,铝粉不能将Fe2+氧化,浓硝酸做氧化剂会产生污染气体,最好选择空气做氧化剂氧化亚铁离子,不会引入新的杂质,不污染环境;
(3)a、加热氯化铵分解后生成的氨气和氯化氢会在试管口重新生成氯化铵,不能制得氨气;
b、氨水滴入氧化钙固体,氧化钙会和水反应生成氢氧化钙放热,使一水合氨分解生成氨气;
c、氢氧化钙和氯化铵固体加热时需要试管口略向下倾斜,图中装置加热时会使生成的水倒流到试管底部炸裂试管;
d、加热浓氨水会分解生成氨气,可以制取氨气;
答案为bd;
(4)检验溶液Z中含NH4+,可利用铵根离子和氢氧根离子加热反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝;方法是取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+;
(5)根据图示n(Fe2O3)=![]() =0.3mol;650℃时固体的质量为43.2g,根据Fe守恒,43.2g固体中n(Fe)=0.6mol,n(O)=
=0.3mol;650℃时固体的质量为43.2g,根据Fe守恒,43.2g固体中n(Fe)=0.6mol,n(O)=![]() =0.6mol,n(Fe):n(O)=1:1,则还原产物为FeO;为验证还原产物,在适量待检物中加入过量稀H2SO4(或稀盐酸)至完全溶解,再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,可说明还原产物为FeO。
=0.6mol,n(Fe):n(O)=1:1,则还原产物为FeO;为验证还原产物,在适量待检物中加入过量稀H2SO4(或稀盐酸)至完全溶解,再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,可说明还原产物为FeO。


科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
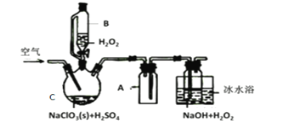
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.1 L 0.1 mol·![]() NH4Cl溶液中,NH4+的数量为0.1NA
NH4Cl溶液中,NH4+的数量为0.1NA
B.2.4g镁在足量的O2中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L CO2气体中含有的氧原子数为0.5NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、N的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是其电子总数的1/4,离子化合物ZX2是一种储氢材料,W与Y属于同一主族,NY2是医学上常用的水消毒剂、漂白剂。下列叙述正确的是 ( )
A.Y和W分别与X形成的简单化合物的热稳定性:X2 Y > X2W
B.离子半径由大到小的顺序为Y2-< Z2+< N-< W2-
C.ZX2和NY2中含有化学键一致,且微粒个数之比均为1 : 2
D.含氧酸的酸性N > W,可证明非金属性:N > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种物质:①甲烷、②苯、③聚丙烯、④聚异戊二烯、⑤2一丁炔、⑥环己烷 ⑦邻二甲苯⑧裂解气,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑦⑧B.④⑤⑧C.④⑤⑦⑧D.③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
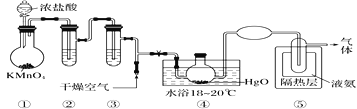
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2O在空气中的百分含量达到25%以上易爆炸;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响。结果如表所示(
废水处理的影响。结果如表所示(![]() 的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )

A.实验ⅱ与实验ⅰ对比,其他条件不变,增加c(H+)有利于![]() 的去除
的去除
B.实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于![]() 的去除
的去除
C.实验ⅲ中Fe3+循环利用提高了![]() 的去除率
的去除率
D.若实验iV中去除0.0l mol ![]() ,电路中共转移0.06 mol电子
,电路中共转移0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A.c(A+)随温度升高而降低B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25℃)>(35℃)D.AB的电离是吸热过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com