
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响。结果如表所示(
废水处理的影响。结果如表所示(![]() 的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )

A.实验ⅱ与实验ⅰ对比,其他条件不变,增加c(H+)有利于![]() 的去除
的去除
B.实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于![]() 的去除
的去除
C.实验ⅲ中Fe3+循环利用提高了![]() 的去除率
的去除率
D.若实验iV中去除0.0l mol ![]() ,电路中共转移0.06 mol电子
,电路中共转移0.06 mol电子
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
【题目】化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
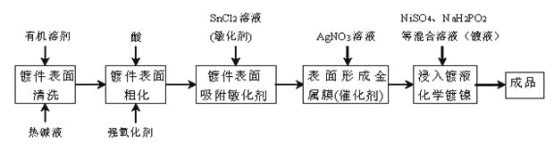
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:

由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:
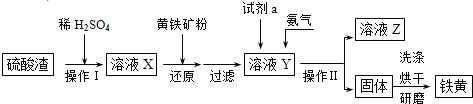
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是___、___。
(2)试剂a最好选用___(供选择使用的有:铝粉、空气、浓HNO3);其作用是___。
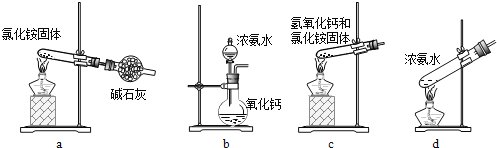
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是___(填序号)。
(4)检验溶液Z中含有NH4+的方法是___。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如图所示。
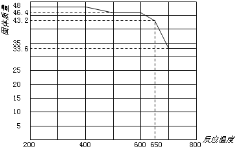
根据图象推断650℃时Fe2O3还原产物的化学式为___,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。___。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
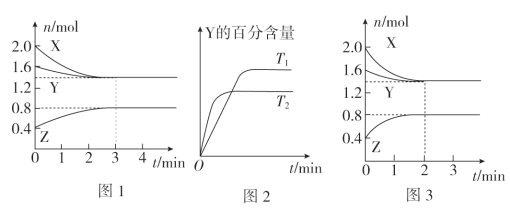
A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液56滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图所示装置进行探究实验制取乙烯并验证乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。

(1)写出该实验中制取乙烯的化学方程式:_____________________。
(2)验证乙烯具有不饱和性的化学方程式是:_________________________
(3)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是________(填字母序号)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.乙醇被氧化生成的气体产物,也会使溴水褪色
(4)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,则A中的试剂应为________,其作用是________,B中的试剂为________。
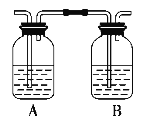
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的c(OH-)的数据分别为甲:1.0×10-7 mol·L-1;乙:1.0×10-6 mol·L-1;丙:1.0×10-2 mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为可能正确的数据是( )
A.甲、乙B.乙、丙C.丙、丁D.乙、丁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com