
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液56滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
【答案】铁氰化钾 2Fe3++2I![]() 2Fe2++I2 使KI过量,再检验是否有Fe3+,以证明该反应为可逆反应 下层呈紫色,上层呈浅绿色 用CCl4萃取碘以后,使平衡右移,Fe3+浓度更小,与SCN-的反应不明显 向试管中加入5ml 0.1mol/L的KI溶液和1-2滴淀粉溶液,加酸调pH=5,钟后观察现象 碘离子浓度过小,氢离子浓度过小(合理即可)
2Fe2++I2 使KI过量,再检验是否有Fe3+,以证明该反应为可逆反应 下层呈紫色,上层呈浅绿色 用CCl4萃取碘以后,使平衡右移,Fe3+浓度更小,与SCN-的反应不明显 向试管中加入5ml 0.1mol/L的KI溶液和1-2滴淀粉溶液,加酸调pH=5,钟后观察现象 碘离子浓度过小,氢离子浓度过小(合理即可)
【解析】
(1) 在含有Fe2+ 的溶液中滴加铁氰化钾溶液有蓝色沉淀生成;
(2) Fe3+与I-发生氧化还原反应生成碘单质;
(3) 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL-1KSCN溶液溶液呈红色,实验Ⅰ滴入几滴反应后仍含铁离子;
(4)I2易溶于CCl4;减小生成物的浓度,平衡会向正反应方向移动。
(5) 已知在酸性较强的条件下,I-可被空气氧化为I2,设计实验可以在酸性弱的条件下观察反应现象分析判断,导致溶液不变蓝的因素可逆是碘离子浓度和氢离子浓度低的原因。
(1) 取实验Ⅰ反应后溶液适量,向溶液中滴加铁氰化钾溶液有蓝色沉淀生成,说明所得溶液中含有Fe2+ ,即反应中生成Fe2+;
(2) Fe3+与I-发生氧化还原反应,所以该反应的离子方程式为:2Fe3++2I-2Fe2++I2;
(3) 实验Ⅱ取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL-1KSCN溶液,溶液变红色,说明KI过量的前提下仍含铁离子,说明反应不能进行彻底,证明反应为可逆反应;
(4) 因I2易溶于CCl4,则实验I的溶液中加入CCl4,振荡静置后可观察到下层呈紫色,上层呈浅绿色;在2Fe3++2I-2Fe2++I2平衡体系中,萃取后I2的浓度降低,平衡正向移动,溶液中Fe3+的浓度极低,向上层清液中滴加KSCN溶液,Fe3+与SCN-的反应不明显,无法看到明显的红色。
(5) 已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:向试管中加入5ml0.1molKI溶液和2滴淀粉溶液,加酸调至PH=5,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是c(I-)浓度低、c(H+)浓度低。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】化合物X由三种元素组成,为探究其组成的性质,设计并完成如下实验:
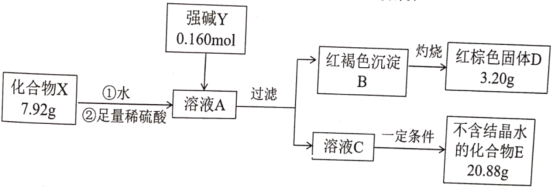
提示:化合物E的焰色反应为紫色(透过蓝色钴玻璃)
请回答:
(1)X的化学式是________________。强碱Y的电子式为________________。
(2)在常温和干燥的条件下,化合物X可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀和一种气体单质。
①化合物X与水反应的离子方程式为________________。
②人们针对化合物X的稳定性进行了大量的研究,并取得了一定的进展。下列物质可以提高化合物X在水溶液中稳定性的是________________。
A KHSO4 B K2CO3 C CH3COOK D K2SO3
③为研究温度对化合物X水溶液稳定性的影响,请设计一个实验方案:________________________________________________。
(3)化合物X有多种制备方法其中一种方法是在强碱Y条件下用次氯酸钾与红褐色沉淀B反应,其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种物质:①甲烷、②苯、③聚丙烯、④聚异戊二烯、⑤2一丁炔、⑥环己烷 ⑦邻二甲苯⑧裂解气,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑦⑧B.④⑤⑧C.④⑤⑦⑧D.③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
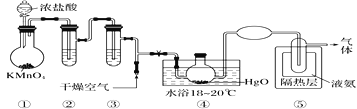
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2O在空气中的百分含量达到25%以上易爆炸;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
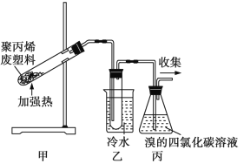
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响。结果如表所示(
废水处理的影响。结果如表所示(![]() 的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )

A.实验ⅱ与实验ⅰ对比,其他条件不变,增加c(H+)有利于![]() 的去除
的去除
B.实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于![]() 的去除
的去除
C.实验ⅲ中Fe3+循环利用提高了![]() 的去除率
的去除率
D.若实验iV中去除0.0l mol ![]() ,电路中共转移0.06 mol电子
,电路中共转移0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.含有羟基的化合物一定属于醇类
B.代表醇类的官能团是与非苯环上的碳相连的羟基
C.酚类和醇类具有相同的官能团,因而具有相同的化学性质
D.分子内有苯环和羟基的化合物一定是酚类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中![]() 的物质的量浓度为
的物质的量浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如下图所示:
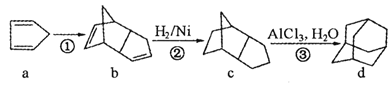
关于以上有机物的说法中,不正确的是
A. a分子中所有原子均在同一平面内 B. a和Br2按1:1加成的产物有两种
C. d的一氯代物有两种 D. c与d的分子式相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com