
【题目】有八种物质:①甲烷、②苯、③聚丙烯、④聚异戊二烯、⑤2一丁炔、⑥环己烷 ⑦邻二甲苯⑧裂解气,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑦⑧B.④⑤⑧C.④⑤⑦⑧D.③④⑤⑧
【答案】B
【解析】
①甲烷结构稳定,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选①;
②苯不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选②;
③聚丙烯![]() 不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选③;
不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选③;
④聚异戊二烯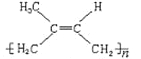 ,含有碳碳双键,能使酸性KMnO4溶液褪色也能与溴水反应,故选④;
,含有碳碳双键,能使酸性KMnO4溶液褪色也能与溴水反应,故选④;
⑤2一丁炔![]() 含有碳碳叁键,能使酸性KMnO4溶液褪色也能与溴水反应,故选⑤;
含有碳碳叁键,能使酸性KMnO4溶液褪色也能与溴水反应,故选⑤;
⑥环己烷,不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选⑥;
⑦邻二甲苯能被高锰酸钾氧化为对苯二甲酸,能使酸性KMnO4溶液褪色,不能与溴水反应,故不选⑦;
⑧裂解气,含有乙烯、丙烯等,能使酸性KMnO4溶液褪色也能与溴水反应,故选⑧;
选B。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为![]() ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,D为既能溶于强酸又能溶于强碱的白色胶状物质,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,D为既能溶于强酸又能溶于强碱的白色胶状物质,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
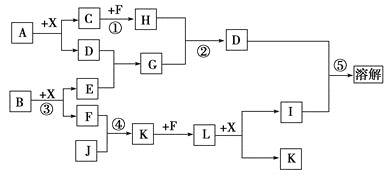
(1)写出A的化学式:________
(2)写出 B的电子式______________
(3)反应![]() 中每生成
中每生成![]() ,转移电子的数目为________
,转移电子的数目为________![]() 用
用![]() 表示阿伏加德罗常数
表示阿伏加德罗常数![]()
(4)反应![]() 的化学方程式为:______________________________
的化学方程式为:______________________________
(5)写出H不足时反应![]() 的离子方程式_______________________________________
的离子方程式_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有___,加MgO后过滤所得滤渣的主要成分为___。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:___。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①___;②___;③___;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:___
②产品中Mg(ClO3)2·6H2O的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A.向0.1mol/LNH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B.向0.1mol/L的KOH溶液中通入标准状况下的CO2气体3.36L,所得溶液中:c(K+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
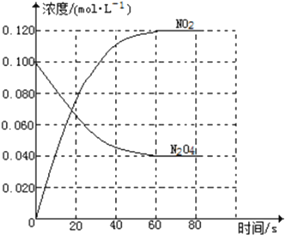
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:
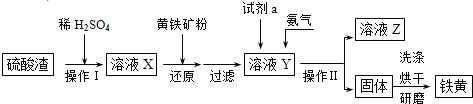
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是___、___。
(2)试剂a最好选用___(供选择使用的有:铝粉、空气、浓HNO3);其作用是___。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是___(填序号)。
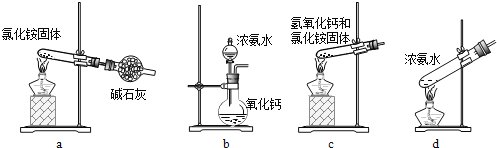
(4)检验溶液Z中含有NH4+的方法是___。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如图所示。
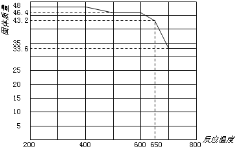
根据图象推断650℃时Fe2O3还原产物的化学式为___,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。___。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
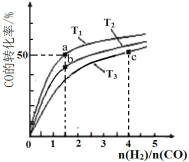
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液56滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结简式如图所示。

①基态Cu原子的价电子排布式为_________,在元素周期表中铜位于_________区(填“s”“p”“d”或“ds”)。
②C、N、O三种元素的第一电离能由大到小的顺序为_________。
③邻氨基吡啶的铜配合物中,Cu2+的配位数是_________,N原子的杂化类型为_________。
(2)C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。
①有关C60和N60的说法中正确的是_________。
A.C60和N60均属于分子晶体 B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化 D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为___________ (填“极性键”“非极性键”)。
(3)原子坐标参数和晶胞参数是晶胞的两个基本参数。
①图中原子坐标参数分别为:A(0,0,0),B(1/2,1/2,0),C(1/2,0,1/2),则D的原子坐标参数为_________。

②图为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为_________g·cm-3(用含R、NA的式子表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com