
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
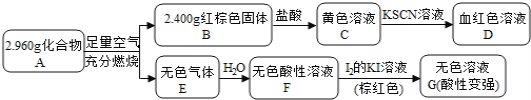
已知E是形成酸雨的主要气体,请回答:
(1)A的组成元素为______(用化学符号表示);
(2)C溶液可溶解铜片,写出该反应的离子方程式______________________________;
(3)写出F→G反应的化学方程式_________________________________,设计实验证明溶液G中含有![]() ____________________________________________________________________。
____________________________________________________________________。
【答案】Fe、S 2Fe3++Cu=Cu2++2Fe2+ H2SO3+I2+H2O=H2SO4+2HI 取溶液G少许,先加入稀盐酸无现象,再加入过量BaCl2溶液,若产生白色沉淀,则有![]()
【解析】
黄色溶液C中加入KSCN溶液变为血红色溶液D,所以黄色溶液C中含有Fe3+,所以红棕色固体应为Fe2O3;无色气体E溶于水形成无色酸性溶液,加入碘的KI溶液,溶液褪色,且酸性变强,可知无色气体E应为还原性酸性气体,且是形成酸雨的主要气体,则E应为SO2;化合物A在足量空气中充分燃烧生成Fe2O3和SO2,所以化合物A中应含有Fe、S两种元素。
(1)化合物A在足量空气中充分燃烧生成Fe2O3和SO2,所以化合物A中应含有Fe、S两种元素;
(2)C为氧化铁和盐酸反应生成,其溶质主要为FeCl3,铁离子可以氧化铜单质,离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(3)F到G为碘单质在水溶液中氧化SO2生成硫酸的反应,根据电子守恒和元素守恒可得化学方程式为H2SO3+I2+H2O=H2SO4+2HI;硫酸钡为不溶于酸和碱的沉淀,据此可以检验硫酸根,具体操作为:取溶液G少许,先加入稀盐酸无现象,再加入过量BaCl2溶液,若产生白色沉淀,则有![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)![]() N2O4(g), 升高温度平衡体系颜色变深
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多金属元素都能以硫化物的形式存在,硫铁矿(FeS2)就是其中一种,在矿区,开采出的硫铁矿石暴露在空气和水中,会发生下图所示转化。回答下列问题:

⑴FeS2的氧化产物Fe2(SO4)3易______,会使地下水和土壤呈______性;如果矿区中的水流或降雨不断淋洗硫铁矿,FeS2最终转化为____________。
⑵写出FeS2的电子式:____________。
⑶写出图中①③两个反应的离子方程式:
①____________________________________,
③____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。下表为元素有关信息:
元素 | 信息 |
B | 其单质在常温下为双原子分子,与A可形成分子X,且X的水溶液呈碱性 |
D | 其简单阳离子与X具有相同电子数,且是同周期中简单阳离子中半径最小的 |
E | 元素原子最外层比次外层少2个电子 |
C、F | 两种元素的原子最外层共有13个电子 |
回答下列问题:
(1)B的原子结构示意图为__,且在周期表中的位置为___。
(2)写出BA3气体验满的方法__。
(3)F的单质在氧化还原反应中常做__剂,该单质与E的低价氧化物1:1通入水中,发生反应的离子方程式为__。
(4)C、D形成的化合物的化学式为__,此物质对应的水化物决定了在物质的分类中应属于__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌为白色固体,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是 MnO2。回答下列问题:
(1)为加快步骤①的浸取速率,下列措施中无法达到目的是_____(填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌
d.适当增加硫酸浓度 e.适当升高温度
(2)反应②中除掉的杂质离子是_____(填离子符号),发生反应的离子方程式为:_____。
(3)加入高锰酸钾溶液前,若 pH 较低,对除杂的影响是_____。
(4)步骤③过滤得到的滤渣中,除了过量的锌外还有_____。
(5)反应④中产物的成分可能是 ZnCO3xZn(OH)2。取干燥后的滤饼 11.2 g,煅烧后可得到产品 8.1 g,则 x=_____(ZnCO3、Zn(OH)2 的相对分子质量分别为:125、99)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示已知[
随pH的变化如图所示已知[![]() ]。
]。
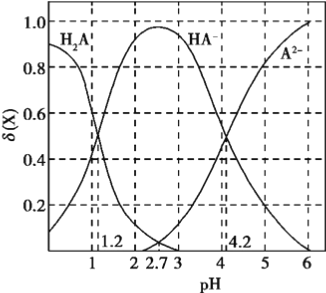
下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-)>c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
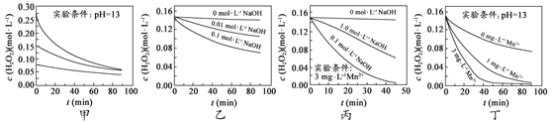
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com