
【题目】大地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂粉精是常用的消毒剂。
(1)工业上制取漂粉精的化学方程式为______________________,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量________________.
(2)漂粉精暴露在空气中易失效的主要原因是___________、_______________(用化学方程式表示)
(3)浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂粉精和浓盐酸反应制得的氯气中,可能含有的杂质气体是__________.
【答案】2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 少量稀盐酸或醋酸 Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 2HClO![]() 2HCl+O2↑ CO2、HCl和水蒸气
2HCl+O2↑ CO2、HCl和水蒸气
【解析】
(1)工业上利用氯气与石灰乳为原料制备漂粉精,氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
强酸制弱酸的原理,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量稀盐酸或醋酸;
(2)漂粉精的主要成分Ca(ClO)2易吸收空气中的水和CO2而生成HClO,发生反应Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;且HClO的稳定性差,易分解生成无漂白性的物质,发生反应的化学方程式为2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(3)漂白粉久置易变质,生成碳酸钙和次氯酸,次氯酸见光易分解,所以贮存较久的漂白粉中含有次氯酸钙和碳酸钙,和浓盐酸反应时会生成CO2。又因为浓盐酸易挥发,所以生成的杂质气体是CO2、HCl和水蒸气,但没有氧气;
答案为CO2、HCl和水蒸气。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
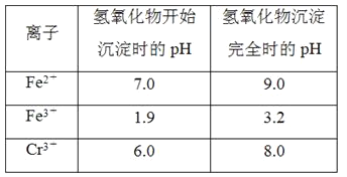
(1)某含铬废水处理的主要流程如图所示:
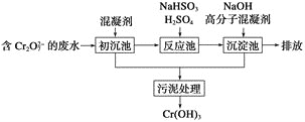
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
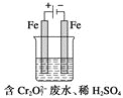
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ. (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等方面具有十分广泛的应用。
Ⅰ.工业生产精细化工产品乙二醛(OHC—CHO)
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,此反应的化学方程式为_____________,该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点: ___________________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:2H2(g)+O2(g) 2H2O(g) ΔH=-484 kJ/mol,化学平衡常数为K1。
OHC—CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78 kJ/mol,化学平衡常数为K2。
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC—CHO(g)+2H2O(g)的ΔH=______。相同温度下,该反应的化学平衡常数K=_______(用含K1、K2的代数式表示)。
②当原料气中氧醇比为4∶3时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495 ℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____________、___________。
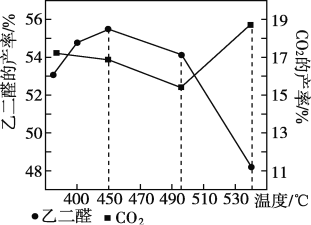
Ⅱ.副产物CO2的再利用
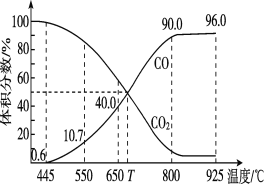
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
A.550℃时,若充入氢气,则v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25%
C.T℃时,若再充入等物质的量的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
已知:计算用平衡分压代替平衡浓度,气体分压(p分)=气体总压(p总)×体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MnO2![]() Cl2
Cl2![]() SiCl4
SiCl4
B. Ca(ClO)2![]() HClO
HClO![]() HCl
HCl
C. 浓H2SO4![]() SO2
SO2![]() BaSO4
BaSO4
D. SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
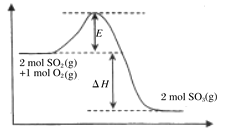
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:由图中曲线变化可知,该反应为_____(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的______。
A.ΔH B.E C. ΔH-E D. ΔH+E
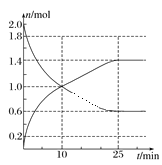
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,如图是部分反应物随时间的变化曲线。
①10min时,v(SO3)=________。
②反应达到平衡时,SO2的转化率为_______。
③下列情况能说明该反应达到化学平衡的是_______。
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com