
����Ŀ��̼���仯�������л��ϳɡ���Դ�����ȷ������ʮ�ֹ㷺��Ӧ�á�
��.��ҵ������ϸ������Ʒ�Ҷ�ȩ(OHC��CHO)
(1)��ȩ(CH3CHO)Һ������������
��Cu(NO3)2���£���ϡ����������ȩ��ȡ�Ҷ�ȩ���˷�Ӧ�Ļ�ѧ����ʽΪ_____________���÷�����ԭ���á���Ӧ�����º͵��ŵ㣬��Ҳ���ڱȽ����Ե�ȱ�㣺 ___________________��
(2)�Ҷ���(HOCH2CH2OH)����������
����֪��2H2(g)+O2(g) 2H2O(g)�� ��H=��484 kJ/mol����ѧƽ�ⳣ��ΪK1��
OHC��CHO(g)+2H2(g) HOCH2CH2OH(g) ��H=��78 kJ/mol����ѧƽ�ⳣ��ΪK2��
���Ҷ�������������ӦHOCH2CH2OH(g)��O2(g) OHC��CHO(g)��2H2O(g)����H=______����ͬ�¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ��K=_______(�ú�K1��K2�Ĵ���ʽ��ʾ)��
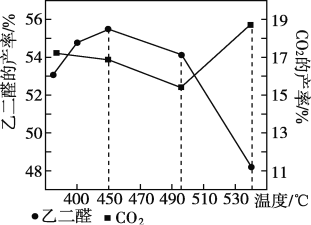
�ڵ�ԭ������������Ϊ4��3ʱ���Ҷ�ȩ������CO2�IJ����뷴Ӧ�¶ȵĹ�ϵ����ͼ��ʾ����Ӧ�¶���450��495 ��֮��ͳ���495��ʱ���Ҷ�ȩ���ʽ��͵���Ҫԭ��ֱ���____________��___________��
��.������CO2��������
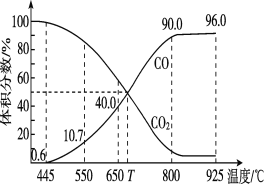
(3)һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�����ӦC(s)��CO2(g) 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��������˵����ȷ����______(����ĸ)��
A.550��ʱ����������������v����v������С��ƽ�ⲻ�ƶ�
B.650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25%
C.T��ʱ�����ٳ�������ʵ�����CO2��CO��ƽ�����淴Ӧ�����ƶ�
D.925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp��24.0p��
��֪��������ƽ���ѹ����ƽ��Ũ�ȣ������ѹ(p��)=������ѹ(p��)�����������
���𰸡�3CH3CHO+4HNO3![]() 3OHC��CHO+4NO��+5H2O ���ɵ�NO����Ⱦ����������ḯʴ�豸 ��406 kJ/mol
3OHC��CHO+4NO��+5H2O ���ɵ�NO����Ⱦ����������ḯʴ�豸 ��406 kJ/mol ![]() �����¶ȣ�����Ӧƽ�������ƶ� �¶ȳ���495 ��ʱ���Ҷ�������ת��Ϊ������̼�ȸ����� B
�����¶ȣ�����Ӧƽ�������ƶ� �¶ȳ���495 ��ʱ���Ҷ�������ת��Ϊ������̼�ȸ����� B
��������
(1)����������ͭ����Ӧ������ȩ��ϡ���ᣬ���������Ҷ�ȩ��NO��ˮ�����ݷ�Ӧʽ����������д����ʽ���÷�Ӧ����Ҫ���и�ʴ�����ᣬ�������ж�����NO��
(2)��OHC-CHO(g)+2H2(g)HOCH2CH2OH(g) ��H=-78kJ/mol
2H2(g)+O2(g)2H2O(g) ��H=-484kJ/mol
����������ʽ�����HOCH2CH2OH(g)+O2(g)OHC-CHO(g)+2H2O(g)����H������Ӧ�ĸı䣬����ʽ�����ƽ�ⳣ�������
�ڴ��¶ȶԻ�ѧƽ���ƶ���Ӱ�켰�¶ȸ߷�������Ӧ������
�¶����ߣ�ƽ�������ȷ����ƶ����¶ȴ���495�������̼��������
(3)A.�ɱ�ĺ�ѹ�ܱ������з�Ӧ��550��ʱ�������뷴Ӧ��ϵ�ص����壬�൱�ڼ�Сѹǿ����v����v������С���ָ÷�Ӧ�������������ķ�Ӧ��ƽ�������ƶ���
B.��ͼ��֪��650��ʱ����Ӧ��ƽ���CO���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol����������ʽ���м��㣻
C.��ͼ��֪��T��ʱ����Ӧ��ƽ���CO��CO2�����������Ϊ50%��Ϊƽ��״̬��
D.925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=![]() ���ݴ˼��㡣
���ݴ˼��㡣
(1)��Cu(NO3)2���£���ϡ����������ȩ��ȡ�Ҷ�ȩ�����ᱻ��ԭΪNO����Ӧ����ʽΪ��3CH3CHO+4HNO3![]() 3OHC��CHO+4NO��+5H2O���÷�Ӧ�ķ�Ӧ���������ǿ�ҵĸ�ʴ�ԣ����ҷ�Ӧ��������NO������ɿ�����Ⱦ����˸÷������ڱȽ����Ե�ȱ���ǣ����ɵ�NO����Ⱦ����������ḯʴ�豸��
3OHC��CHO+4NO��+5H2O���÷�Ӧ�ķ�Ӧ���������ǿ�ҵĸ�ʴ�ԣ����ҷ�Ӧ��������NO������ɿ�����Ⱦ����˸÷������ڱȽ����Ե�ȱ���ǣ����ɵ�NO����Ⱦ����������ḯʴ�豸��
(2)��a.OHC-CHO(g)+2H2(g)HOCH2CH2OH(g) ��H=-78kJ/mol
b.2H2(g)+O2(g)2H2O(g) ��H=-484kJ/mol
b-a�������ɵã���ȥ��һ������ʽ��HOCH2CH2OH(g)+O2(g)OHC-CHO(g)+2H2O(g)����H=(-484kJ/mol)-(-78 kJ/mol)=��406kJ/mol��K1=![]() ��K2=
��K2=![]() ��
��![]() =
=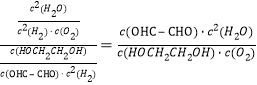 ����ѧƽ�ⳣ��K=
����ѧƽ�ⳣ��K=![]() ������K=
������K=![]() ��
��
������ӦHOCH2CH2OH(g)+O2(g)OHC-CHO(g)+2H2O(g) ��H=��406kJ/molΪ���ȷ�Ӧ������Ӧ�ﵽƽ��������¶�ƽ�������ƶ���ʹ�Ҷ�ȩ���ʽ��ͣ����ҵ��¶ȳ���495��ʱ����Ӧ���Ҷ����д�����������Ӧ��ת��ΪCO2�ȸ����Ҳ��ʹ�Ҷ�ȩ���ʽ��ͣ�
(3)A.�ڿɱ�ĺ�ѹ�ܱ������з�Ӧ��550��ʱ�������뷴Ӧ��ϵ�ص�������H2���൱�ڼ�С��ѹǿ�����ڷ�Ӧ������Ũ�ȼ�С������v����v������С������Ϊ�÷�Ӧ������Ӧ�������������ķ�Ӧ�����Լ�Сѹǿ����ѧƽ�������ƶ���A����
B.��ͼ��֪��650��ʱ����Ӧ��ƽ���CO���������Ϊ40%���迪ʼ����Ķ�����̼Ϊ1mol����Ӧ��Ӧת����xmol������
C(s)��CO2(g) 2CO(g)��
��ʼ 1 0
ת�� x 2x
ƽ�� 1-x
����![]() ��100%=40%�����x=0.25mol������CO2��ת����Ϊ
��100%=40%�����x=0.25mol������CO2��ת����Ϊ![]() ��100%=25%��B��ȷ��
��100%=25%��B��ȷ��
C.��ͼ��֪��T��ʱ����Ӧ��ƽ���CO��CO2�����������Ϊ50%��Ϊƽ��״̬�����ټ�������ʵ�����CO��CO2����Ӧ��ϵ�������������壬���ߵĺ������䣬����ƽ�ⲻ�ƶ���C����
D.925��ʱ��CO���������Ϊ96%����CO2�����������Ϊ4%��������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=![]() =
=![]() =23.0P��D����
=23.0P��D����
�ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. MnO2+ 4HCl��Ũ��![]() MnCl2 +Cl2�� + 2H2O�У��������ͻ�ԭ�����ʵ���֮��Ϊ1��4
MnCl2 +Cl2�� + 2H2O�У��������ͻ�ԭ�����ʵ���֮��Ϊ1��4
B. 2H2S+ SO2��3S+2H2O�У���������ͻ�ԭ�������ʵ���֮��Ϊ1��1
C. 3S+ 6KOH��2K2S+ K2SO3+3H2O�У��������ͱ���ԭ����Ԫ�����ʵ���֮��Ϊ2��1
D. Al2O3��N2��3C![]() 2AlN��3CO�У��������ͻ�ԭ�����ʵ���֮��Ϊ1��3
2AlN��3CO�У��������ͻ�ԭ�����ʵ���֮��Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2CO3��NaAlO2�Ļ����Һ����μ���1 mol��L��1�����ᣬ�����Һ�е�HCO3-��CO32-��AlO2-��Al3�����ӵ����ʵ��������������Һ������仯��ϵ��ͼ��ʾ��������˵����ȷ������ ��

A��ԭ�����Һ�е�CO32-��AlO2-�����ʵ���֮��Ϊ1��2
B��V1��V2��1��5
C��M��ʱ���ɵ�CO2Ϊ0.05 mol
D��e���߱�ʾ�����ӷ���ʽΪAl(OH)3��3H��===Al3����3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ������ɱ����Ϊ���ƴ��ģ��Ⱦ�Լ�����������Ч����֮һ��Ư�۾��dz��õ���������
��1����ҵ����ȡƯ�۾��Ļ�ѧ����ʽΪ______________________,��ʹ��Ư�۾�ʱ��Ϊ�˼���Ư�����ã�������Ư�۾��м�������________________.
��2��Ư�۾���¶�ڿ�������ʧЧ����Ҫԭ����___________��_______________���û�ѧ����ʽ��ʾ��
��3��Ũ����ʹ�������ܷ������·�ӦCa(ClO)2+4HCl(Ũ)=CaCl2+2Cl2��+2H2O��������ܾõ�Ư�۾���Ũ���ᷴӦ�Ƶõ������У����ܺ��е�����������__________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij�л���Ľṹ��ʾΪ![]() ����������________________________��
����������________________________��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ��
�ٲ�����ʹ���Ը��������Һ��ɫ��____________________________________��
�ڰ�Ũ���ᡢŨ����ͼױ���ϼ����Ʊ�TNT��______________________________��
����������һ�������·�����ȥ��Ӧ��__________________________________��
(3)ij��A������̼����������Ϊ90.57%����ij�¶���V L������������������ͬ״����V L H2������53��������A�ķ���ʽΪ______________������A�����к��б������ұ����ϵ�һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
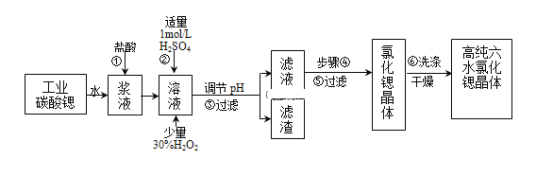
����Ŀ����ҵ����������ˮ��̼����(SrCO3)��ĩΪԭ��(�������������Ļ�����)�Ʊ��ߴ���ˮ�Ȼ��Ⱦ���(SrCl26H2O)�������Ϊ��
��֪�����й��������������pH��
�������� | Fe(OH)3 | Fe(OH)2 |
��ʼ������pH | 1.5 | 6.5 |
������ȫ��pH | 3.7 | 9.7 |
��SrCl26H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
(1)��������Ҫ�ӿ췴Ӧ���ʣ���ʩ�г�ֽ����______(дһ��)��̼���������ᷴӦ�����ӷ���ʽ______��
(2)�ڲ����-�۵Ĺ����У�����Һ��pHֵ��1������______�����õ��Լ�Ϊ______��
A.1.5B.3.7C.9.7D����ˮE���������ȷ�ĩF��̼���ƾ���
(3)��������������������Ҫ�ɷ���______(�ѧʽ)��
(4)��ҵ�����ȷ紵����ˮ�Ȼ��ȣ����˵��¶���______
A��50��60��B��80��100��C��100������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ�������й�˵����ȷ����
A. 60g�����ᾧ���У�����������ĿΪNA
B. ��״���£�22.4LCCl4�к��з��ӵ���ĿΪNA
C. �����£�46gNO2��N2O4��������к�������ΪNA
D. 32gCuͶ��300mL10mol/L��Ũ�����У���ַ�Ӧ��ת�Ƶ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������������������ȼ�գ����û������100mL 3.00mol/L��NaOH��Һ���ܶ�Ϊ1.12g/mL��ǡ����ȫ���գ������Һ�к���NaClO�����ʵ���Ϊ0.0500mol��
��1��ԭNaOH��Һ����������Ϊ
��2��������Һ��Cl�������ʵ���Ϊ mol
��3�����������Ͳμӷ�Ӧ�����������ʵ���֮��n(Cl2)��n(H2)�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮������Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�2mLѪҺ������ˮϡ�ͺ������м�����������泥�NH4��2C2O4���壬��Ӧ���� CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0��4 mol/L��KMnO4��Һ��
��1��д����KMn04�ζ�H2C2O4�����ӷ���ʽ_____________________��
��2���ζ�ʱ����KMnO4��Һװ��________�����ʽ����ʽ�����ζ����С�
��3���жϵζ��յ�ķ�����________________________��
��4�������������ƫ�ߡ�����ƫ�͡�����Ӱ�족��
������ζ���������ˮϴ��δ������KMnO4��Һ��ϴ����������________��
�ڵζ�ǰ���������ȷ�����ζ�ǰ�����ݣ����ζ���������ʧ����������________��
��5�����㣺ѪҺ�к������ӵ�Ũ��Ϊ________mol/L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com