
【题目】A是一种红棕色金属氧化物,B、D是金属单质。
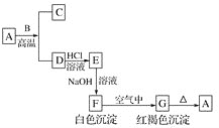
(1)写出下列物质的化学式:A________、E________、F________、G________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_________________________________;
②F→G的化学方程式:________________________________________________;
③E→F的离子方程式:________________________________________。
【答案】Fe2O3 FeCl2 Fe(OH)2 Fe(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2++2OH-===Fe(OH)2↓
2Fe+Al2O3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2++2OH-===Fe(OH)2↓
【解析】
A是一种红棕色金属氧化物,则A是Fe2O3,B、D是金属单质,A和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3, G是红褐色沉淀,分解生成氧化铁,则G是Fe(OH)3,F是Fe(OH)2,铁和盐酸反应生成氯化亚铁和氢气,E和氢氧化钠溶液反应生成Fe(OH)2,则E是FeCl2,结合物质的性质分析解答.
(1)通过以上分析知,A、E、F、G分别是:Fe2O3、FeCl2、Fe(OH)2、Fe(OH)3,
故答案为:Fe2O3;FeCl2;Fe(OH)2;Fe(OH)3;
(2)①A是氧化铁,B是铝,二者在高温下发生铝热反应生成铁和氧化铝,反应方程式为:2Al+Fe2O3![]() 2Fe+Al2O3 ,故答案为:2Al+Fe2O3
2Fe+Al2O3 ,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3 ;
2Fe+Al2O3 ;
②F是氢氧化亚铁,氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③E是氯化亚铁溶液,与氢氧化钠溶液反应生成氢氧化亚铁和氯化钠,故离子方程式是Fe2++2OH-===Fe(OH)2↓;
故答案为:Fe2++2OH-===Fe(OH)2↓。


科目:高中化学 来源: 题型:
【题目】氯化镁晶体在加热时会发生如下变化:![]() ;
;![]() 。研究人员称取氯化镁晶体ag,经加热后得到固体bg。
。研究人员称取氯化镁晶体ag,经加热后得到固体bg。
已知:
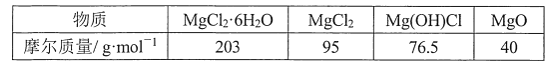
(1)若bg固体为等物质的量的![]() 、MgO混合物,则a与b的关系是____(用分数表示)。
、MgO混合物,则a与b的关系是____(用分数表示)。
(2)若在干燥的HCl气流中加热,得到MgCl2、![]() 的固体
的固体![]() ,则它们的物质的量之比为____。
,则它们的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物溶解后的溶液可能含有Na+、K+、![]() 、
、![]() 、
、![]() 中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)。下列说法不正确的是
中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)。下列说法不正确的是
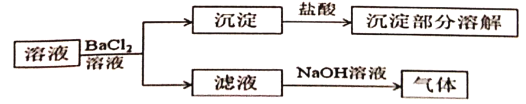
A.原固体可能是硫酸铵和碳酸钠B.原固体可能是碳酸铵和硫酸钠
C.原固体不可能是硫酸铵和碳酸钾D.原固体不可能是碳酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图
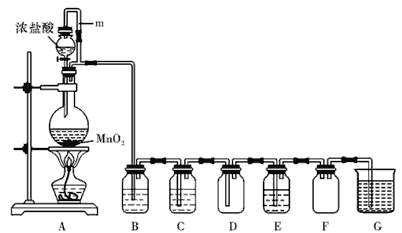
(1)圆底烧瓶中发生反应的化学方程为
(2)若要得到干燥纯净的气体,则B中应盛放的试剂是 C中应盛放的试剂是
(3)E中若装有淀粉碘化钾溶液,能观察到的实验现象是
(4)G中发生反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体在加热条件下可以完全分解成为气体而除去 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包固体可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展如图所示的实验:
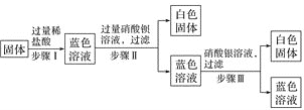
已知:①步骤Ⅰ中固体全部溶解,溶液呈蓝色,且无气泡产生。
②步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是___________________________________________(填化学式)。
(2)原固体中一定不含有的物质是________________________________________(填化学式),原因是________________________________________________________________________。
(3)写出步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式:___________________________________。
(4)步骤Ⅲ所得蓝色溶液中一定含有的溶质是_____________________________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①![]()
![]()
②![]()
![]()
下列判断不正确的是( )
A.①中的![]() 为固态,②中的
为固态,②中的![]() 为气态
为气态
B.①的反应物总能量比②的反应物总能量高
C.反应①的产物与反应②的产物热稳定性相同
D.1mol 固态碘完全升华会吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
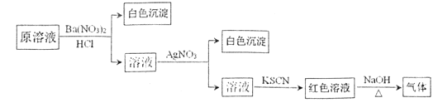
A.原溶液中一定含有![]() 离子B.原溶液中一定含有
离子B.原溶液中一定含有![]()
C.原溶液中一定含有Cl-离子D.原溶液中一定含有Fe3+离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com