
【题目】“一碳化学”是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。发展“一碳化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“一碳化学”途径制取乙二醇的过程:
(1)在容积为2L的密闭容器中,由CO和H2合成乙醇的反应为
2CO(g)+ 4H2(g)![]() CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
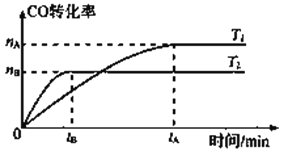
①根据上图可推知该反应ΔH_________0(填“>”、“<”或“=”)。
②该反应的平衡常数表达式为____________,降低温度平衡常数将_____(填“变大”、“变小”或“不变”)。
③下列说法中能判断该反应达到化学平衡状态的是_________(选填编号)。
a.容器中的压强不变 b.混合气体的密度不再变化
c.v正(CO)=2v逆(H2O) d.混合气体的平均相对分子质量不再变化
(2)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①用离子方程式解释KHC2O4溶液显酸性的原因:_______________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是________(填序号)。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
(3)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式______________________________。以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为_____________。
【答案】 < K= ![]() 变大 a c d HC2O4-
变大 a c d HC2O4- ![]() H++C2O42-, HC2O4-+H2OH2C2O4+OH-,因为电离程度大于水解程度,所以呈酸性 a d CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol CH3OH+H2O-6e-=CO2+6H+
H++C2O42-, HC2O4-+H2OH2C2O4+OH-,因为电离程度大于水解程度,所以呈酸性 a d CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol CH3OH+H2O-6e-=CO2+6H+
【解析】(1)① 根据上图可知,T2达到平衡时间较短,反应速率较快,温度较高,T2条件下CO的转化率较T1的低,则温度越高,转化率越低,可推知对于反应2CO(g)+ 4H2(g) ![]() CH3CH2OH(g)+ H2O(g),升高温度,平衡向该反应逆反应方向移动,ΔH<0;②根据反应2CO(g)+ 4H2(g)
CH3CH2OH(g)+ H2O(g),升高温度,平衡向该反应逆反应方向移动,ΔH<0;②根据反应2CO(g)+ 4H2(g) ![]() CH3CH2OH(g)+ H2O(g)可得平衡常数表达式为K=
CH3CH2OH(g)+ H2O(g)可得平衡常数表达式为K=![]() ,降低温度,平衡向正反应方向移动,生成物的浓度增大,反应物的浓度降低,则平衡常数将变大;③a.该反应正反应方向为气体体积减小的方向,反应未达平衡时,容器中压强始终会变化,当压强不变时,说明反应到达平衡,选项a正确; b.反应在在容积为2L的密闭容器中,反应物都为气体,气体的总质量不变,容器的体积始终不变,则密度始终不变,不能说明反应到达平衡,选项b错误; c.根据反应可知,自始至终v正(CO)=2v正(H2O),若v正(CO)=2v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,选项c正确; d.该反应只有气体参加且正反应方向为气体体积减小的方向,根据M(平)=
,降低温度,平衡向正反应方向移动,生成物的浓度增大,反应物的浓度降低,则平衡常数将变大;③a.该反应正反应方向为气体体积减小的方向,反应未达平衡时,容器中压强始终会变化,当压强不变时,说明反应到达平衡,选项a正确; b.反应在在容积为2L的密闭容器中,反应物都为气体,气体的总质量不变,容器的体积始终不变,则密度始终不变,不能说明反应到达平衡,选项b错误; c.根据反应可知,自始至终v正(CO)=2v正(H2O),若v正(CO)=2v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,选项c正确; d.该反应只有气体参加且正反应方向为气体体积减小的方向,根据M(平)=![]() ,反应未达平衡时,混合气体的平均相对分子质量不始终变化,混合气体的平均相对分子质量不变,则说明反应到达平衡状态,选项d错误;答案选:acd;(2) ①KHC2O4溶液中存在电离平衡:HC2O4-
,反应未达平衡时,混合气体的平均相对分子质量不始终变化,混合气体的平均相对分子质量不变,则说明反应到达平衡状态,选项d错误;答案选:acd;(2) ①KHC2O4溶液中存在电离平衡:HC2O4- ![]() H++C2O42-, 水解平衡:HC2O4-+H2OH2C2O4+OH-,溶液显酸性表明它的电离程度大于水解程度,所以呈酸性;②a.根据物料守恒可得c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),选项a正确; b.根据电荷守恒可得c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),选项b错误;c.由物料守恒:c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),电荷守恒:c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),由电荷守恒式子减去物料守恒式子可得:c(Na+) = c(C2O42-) -c(H2C2O4) ,选项c错误;d.若加入的NaOH与KHC2O4恰好反应c(K+) = c(Na+)。此时溶液呈碱性,故加入的NaOH的物质的量要比KHC2O4少,所以c(K+) > c(Na+),选项d正确。答案选ad;(5)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,则CH3OH(l)的燃烧热为677kJ/mol-27kJ/mol=650 kJ/mol,故CH3OH(l)完全燃烧的热化学方程式为:CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol;总反应式为2CH3OH+3O2(g)=2CO2(g)+4H2O,正极是还原反应,氧气在正极放电,酸性条件下获得电子生成水,正极电极反应式为:3O2+12H++12e-=6H2O,总反应式减去正极反应式可得负极电极反应式为:2CH3OH+2H2O-12e-=2CO2+12H+,即CH3OH+H2O-6e-=CO2+6H+。
H++C2O42-, 水解平衡:HC2O4-+H2OH2C2O4+OH-,溶液显酸性表明它的电离程度大于水解程度,所以呈酸性;②a.根据物料守恒可得c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),选项a正确; b.根据电荷守恒可得c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),选项b错误;c.由物料守恒:c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),电荷守恒:c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),由电荷守恒式子减去物料守恒式子可得:c(Na+) = c(C2O42-) -c(H2C2O4) ,选项c错误;d.若加入的NaOH与KHC2O4恰好反应c(K+) = c(Na+)。此时溶液呈碱性,故加入的NaOH的物质的量要比KHC2O4少,所以c(K+) > c(Na+),选项d正确。答案选ad;(5)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,则CH3OH(l)的燃烧热为677kJ/mol-27kJ/mol=650 kJ/mol,故CH3OH(l)完全燃烧的热化学方程式为:CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol;总反应式为2CH3OH+3O2(g)=2CO2(g)+4H2O,正极是还原反应,氧气在正极放电,酸性条件下获得电子生成水,正极电极反应式为:3O2+12H++12e-=6H2O,总反应式减去正极反应式可得负极电极反应式为:2CH3OH+2H2O-12e-=2CO2+12H+,即CH3OH+H2O-6e-=CO2+6H+。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质和用途具有对应关系的是
A.Al2O3的熔点很高,可用作耐火材料
B.浓硫酸具有脱水性,可用于干燥气体
C.SO2具有氧化性,可用于纸浆的漂白
D.氯化铁易水解,可用于腐蚀铜制线路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】_________________________________(用离子方程式表示)
【实验内容及记录】

请回答:
(1)根据上表中的实验数据,可以得到的结论是_______________。
(2)利用实验1中数据计算,用H2C2O4的浓度变化表示的反应速率v(H2C2O4)=________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
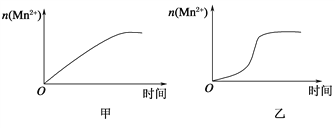
①该小组同学提出的假设是_______________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。__________

③若该小组同学提出的假设成立,应观察到的现象是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ/mol,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的键能为( )
A. 357 kJ·mol-1 B. 516 kJ·mol-1 C. 172 kJ·mol-1 344 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列叙述不正确的是( )
A.高纯硅可用于制作光导纤维
B.碳酸钠热溶液呈碱性,可用于除去餐具上的油污
C.利用太阳能蒸发海水的过程属于物理变化
D.淀粉和纤维素水解的最终产物均为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过你的观察和推理,判断下列实验室中对于少量Na的保存方法正确的是 ( )
A. 保存在水中 B. 密封,保存在广口瓶中
C. 用铝箔包裹,密封在广口瓶中 D. 密封,保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积一定的容器中,可逆反应A(s)+3B(g) ![]() 3C(g)达到平衡的标志是( )
3C(g)达到平衡的标志是( )
A. 容器内每减少1mol A,同时生成3mol C
B. 容器内的气体密度不再改变
C. 混合气体总的物质的量不变
D. 容器内每减少1mol A,同时消耗3mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c (NO2) | c (NO) | c (O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B. 达平衡时,容器Ⅱ中c(O2)/ c(NO2)比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com