
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
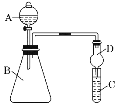
(3)仪器B的名称为____________,干燥管D的作用是防止_____________________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象___________,即可证明。请写出一种制取氯气的化学反应方程式:_______________________________________,从环境保护的角度考虑,此装置缺少尾气处理装置,可用___________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________溶液的洗气瓶。
【答案】钾 铝 S2-+Cl2=S↓+2Cl- 锥形瓶 倒吸 变蓝色 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O NaOH 有白色沉淀生成 饱和NaHCO3
MnCl2+Cl2↑+2H2O NaOH 有白色沉淀生成 饱和NaHCO3
【解析】
根据元素周期律结合实验装置分析解答;书写相关反应化学方程式及离子方程式。
Ⅰ.(1)金属性越强越容易与酸反应置换出氢气,反应越剧烈,所以钾反应最剧烈;反应属于氧化还原反应,根据电子得失守恒分析,产生氢气的多少和金属得失电子数目有关,1molAl反应后失电子数目最多,所以铝与盐酸反应产生的气体最多,故答案为:钾;铝;
(2)向Na2S溶液中通入氯气,反应生成单质硫,说明氯气的氧化性强于硫,则Cl的非金属性比S强,反应的离子方程式为 S2-+Cl2=S↓+2Cl-;
Ⅱ.(3)如图所示,仪器B的名称为锥形瓶;根据实验原理及装置特点分析干燥管D的作用是防止倒吸;
(4)要证明非金属性:Cl>I,可以通过氯气置换出碘化钾中的碘来证明,B中生成的氯气通入C中的淀粉碘化钾,若观察到C中溶液变蓝,说明此时有单质碘生成;浓盐酸被氧化生成氯气的方程式为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;氯气有毒,所以需要尾气处理,氯气与氢氧化钠溶液反应,所以可以用氢氧化钠溶液吸收尾气;
MnCl2+Cl2↑+2H2O;氯气有毒,所以需要尾气处理,氯气与氢氧化钠溶液反应,所以可以用氢氧化钠溶液吸收尾气;
(5)B装置中反应生成二氧化碳气体,二氧化碳通入C中硅酸钠溶液,若溶液有白色沉淀现象,说明生成难溶的硅酸,则碳酸的酸性强于硅酸,非金属性:C>Si;为了防止干扰,要除去二氧化碳气体中的HCl气体,可以用饱和碳酸氢钠溶液洗气。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】(双选)下列关于烯烃、炔烃的叙述中,正确的是( )
A. 某物质的名称为2—乙基—1—丁烯,它的结构简式为![]()
B. CH3—CH===CH—C≡C—CF3分子结构中最多有4个碳原子在一条直线上
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. β月桂烯的结构如图![]() 所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别浓硫酸和稀硫酸,既简单又方便的方法是( )
A.常温下与铜片反应B.与石蕊溶液反应
C.用玻璃棒各蘸少许溶液涂在纸上D.加入锌片看是否有气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料茉莉酮是一种人工合成的有机化合物,其结构简式为![]() ,下列关于茉莉酮的说法正确的是( )
,下列关于茉莉酮的说法正确的是( )
A. 该有机物的化学式是C10H14O
B. 1 mol该有机物与H2充分反应,消耗4 mol H2
C. 该有机物属于不饱和酮类物质,能发生银镜反应
D. 该有机物能发生加成反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯分子式为 C20H28O4,1mol 该酯完全水解得到 1mol 羧酸和 2mol 乙醇,该羧酸的分子式为( )
A.C16H20O4B.C16H25O4C.C14H18O4D.C14H16O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
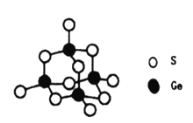
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
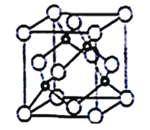
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A. SO2的浓度为0.4 mol·L-1,O2的浓度为0.2 mol·L-1
B. SO2的浓度为0.25 mol·L-1
C. SO3的浓度为0.4 mol·L-1
D. SO2、SO3的浓度均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com