
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: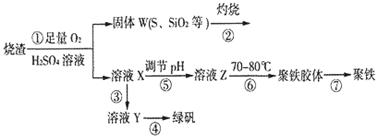
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是__________;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:___________________________________。
(3)过程③中,需加入的物质是___________________________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有_______________。
(5)过程⑤调节pH可选用下列试剂中的___________ (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是_____________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.70g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为___________。(假设杂质中不含铁元素和硫元素)。
(1)ACD (2)4FeS + 3O2 + 6H2SO4 = 2Fe2(SO4)3 + 6H2O+4S (3)Fe(或铁)
(4)蒸发皿、玻璃棒 (5)C (6)促进Fe3+的水解 (7)31.11%
解析试题分析:(1)固体W中含有S在灼烧时会产生SO2气体。A.把SO2通入品红溶液 SO2有漂白性,能使品花溶液褪色。正确。B.SO2的水溶液显酸性,紫色石蕊溶液变为红色。错误。C.SO2有还原性,能被酸性KMnO4溶液氧化为硫酸,KMnO4则被还原为无色的MnSO4 .正确。 D.SO2有还原性,能被溴水氧化为硫酸,溴水被还原为无色的HBr。正确。因此选项为ACD。(2)根据电子守恒和质量守恒定律可得出过程①中,FeS和O2、H2SO4反应的化学方程式为:4FeS+3O2+ 6H2SO4 = 2Fe2(SO4)3 +6H2O + 4S。(3)在溶液X中含有Fe2(SO4)3 和H2SO4,而绿矾是硫酸亚铁晶体。所以过程③中,需加入的物质是还原剂Fe粉。(4) 经过还原Fe粉还原的Fe2(SO4)3 和H2SO4溶液为FeSO4.要从该溶液中得到绿矾,因为硫酸亚铁的溶解度受温度的影响变化较大,所以采用冷却热饱和溶液的方法制取。实验操作有蒸发、浓缩、冷却、结晶。在过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要蒸发皿、玻璃棒 。(5)过程⑤调节pH可选用下列试剂中的应该用碱,相比而言NaOH的溶解度大,杂质离子Na+比Ca2+容易除去。选项为C。(6) Fe2(SO4)3是强酸弱碱盐,水解产生Fe(OH)3胶体。盐的水解反应是吸热反应,在过程⑥中,将溶液Z加热到70一80℃,目的是为了促进Fe3+的水解 。(7)该聚铁在经过酸溶解后,加入过量的氯化钡溶液。得到的沉淀为Ba SO4。n(Ba SO4)= 3.495g÷233g/mol=0.015mol.所以n(Fe)=0.015mol.m(Fe)=0.015mol×56g/mol=0.84g。因此在在聚铁中Fe元素的含量为(0.84g÷2.70g) ×100% =33.11%。
考点:考查SO2的化学性质、方程式的书写、盐的水解、混合物的分离方法、元素的含量的计算的知识。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:填空题
某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: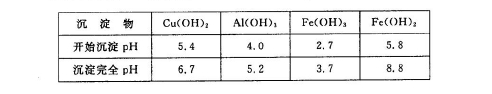
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是 (写2点)。
(2)固体混合物A中的成分是 。
(3)反应I完成后,铁元素的存在形式为 (填离子符号);写出生成该离子的离子方程式 。
(4)操作1主要包括: 、 、 。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为 .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
① ;② ;③ ;④ 。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。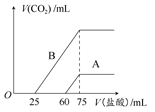
①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。
②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
无水硝酸铜极易吸水,加热到210℃升华,它和Cu(NO3)2 ·3H2O晶体的化学性质有较大差异, Cu(NO3)2 ·3H2O晶体加热到170℃分解。已知:乙酸乙酯的沸点为77 ℃。
(1)加热蒸干Cu(NO3)2 溶液得不到无水硝酸铜的原因是_____________。
(2)将铜片加人到N2 O 4的乙酸乙酯溶液中可制得无水硝酸铜,同时生成NO,写出反应的化学方程式_____________;从乙酸乙醋中分离出无水硝酸铜的实验操作是_____________。
(3)为探究Cu(NO3)2 ·3H2O受热分解的产物,某探究小组利用下图装置进行实验。(图中夹持和加热装置去)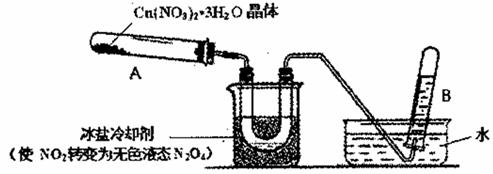
往试管A中加人研细的Cu(NO3)2 ·3H2O体并加热,观察到试管A中有红棕色气生成,最终残留黑色粉末;U型管中有液体生成,在试管B中收集到无色气体。
①当导管口不再有气池冒出时,反应停止,拆除装置的操作首先是______。
②试管B中收集到的气体一定含有______。
(4)锌与Cu(NO3)2溶液能发生反应。在一支试管中注人1 mol·L-1的Cu(NO3)2溶液,再放入一块锌片,观察到在反应初期有大量无色气泡冒出,同时锌片上析出红色固体。该小组猜想气体的成分,并设计的实验步骤,请填写下表。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: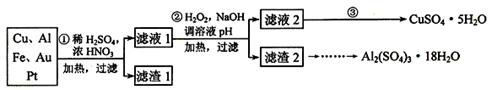
(1)第①步Cu与混酸反应的离子方程式为______________________________。得到滤渣1的主要成分为_________________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________
____________________________________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案: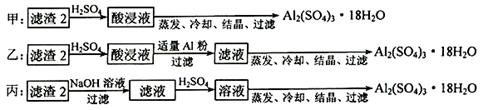
上述三种方案中,_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图: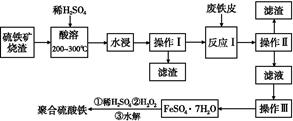
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为 。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是 。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图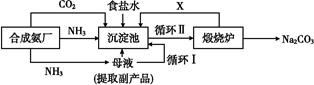
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。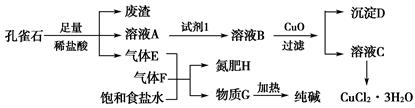
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com