
����Ŀ��ij��ҵ��ˮ�к���CN-��Cr2O72��������,�辭��ˮ������������ŷ�,��ˮ�����������������̽��д���:
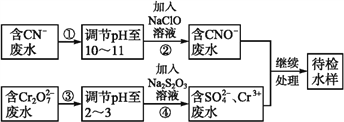
�ش���������:
��1���������,CN-��ClO-����ΪCNO-�����ӷ���ʽΪ_______________��
��2������ܵķ�ӦΪS2+Cr2O72��+H+![]() SO42-+Cr3++H2O(δ��ƽ), ��ÿ����0.4 molCr2O72��ת��ת��____mol e-��
SO42-+Cr3++H2O(δ��ƽ), ��ÿ����0.4 molCr2O72��ת��ת��____mol e-��
��3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ������,Ŀ����_________________��
��4����25 ����,��a mol��L-1��NaCN��Һ��0.01 mol��L-1�������������,��Ӧ������ҺpH=7,�ú�a�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka=____����25 ��ʱ��Ũ�Ⱦ�Ϊ0.1 mol��L-1��NaCN��HCN��Һ�������Ϻ�,��Һ�ʼ���,����ڸ���Һ��˵������ȷ����____(����ĸ)��
a.����Һһ����c(Na+)+c(H+)=c(OH-)+c(CN-)
b.����Һһ����c(Na+)=c(HCN)+c(CN-)
c.�����Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶�
d.����Һ���������������ƻ�����,��Һ��pH�仯����
��5����ȥ��ˮ�е�������:ȡˮ�����Թ���,����NaOH��Һ�۲쵽����ɫ��������,�����������ٲ�����ɫ����Ϊֹ,������Һ�м���һ������Na2S��Һ,��ɫ����ת���ɺ�ɫ�������ù����з�Ӧ�����ӷ���ʽΪ_______��___________��
���𰸡� CN-+ClO-![]() CNO-+Cl- 2.4 ���ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) (100a-1)��10-7 mol��L-1 b Cu2++2OH-
CNO-+Cl- 2.4 ���ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) (100a-1)��10-7 mol��L-1 b Cu2++2OH-![]() Cu(OH)2�� Cu (OH)2(s)+S2-(aq)
Cu(OH)2�� Cu (OH)2(s)+S2-(aq)![]() CuS(s)+2OH-(aq)
CuS(s)+2OH-(aq)
����������1��������������������£�CN��������NaClO����������ԭ��Ӧ����CNO����Cl�����ӣ����ӷ�ӦΪ��CN��+ClO���TCNO��+Cl������2������ܵķ�ӦΪS2+Cr2O72��+H+![]() SO42-+Cr3++H2O(δ��ƽ)������0.4 mol Cr2O72����ת��ΪCr3������Ԫ�ػ��ϼ۽���3�ۣ�0.4molCr2O72�����õ���0.4����2��3��mol=2.4mol����3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) ����4���ɵ���غ�c��Na����+c��H����=c��OH����+c��CN����+c��Cl������pH=7����֪c��H����=c��OH����=10-7 mol��L��1��c��CN����=c��Na����-c��Cl����=a/2mol��L��1-0.01/2mol��L��1���ٸ��������غ㣺c��CN����+c��HCN��=c��Na����=a/2mol��L��1��Ka��c(H��)��c(CN��)/c(HCN)=
SO42-+Cr3++H2O(δ��ƽ)������0.4 mol Cr2O72����ת��ΪCr3������Ԫ�ػ��ϼ۽���3�ۣ�0.4molCr2O72�����õ���0.4����2��3��mol=2.4mol����3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮ��pH,ʹ��ת����Cr(OH)3����������ȥ(����������Ҳ��) ����4���ɵ���غ�c��Na����+c��H����=c��OH����+c��CN����+c��Cl������pH=7����֪c��H����=c��OH����=10-7 mol��L��1��c��CN����=c��Na����-c��Cl����=a/2mol��L��1-0.01/2mol��L��1���ٸ��������غ㣺c��CN����+c��HCN��=c��Na����=a/2mol��L��1��Ka��c(H��)��c(CN��)/c(HCN)=
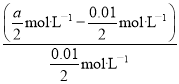 = (100a-1)��10-7 mol��L-1����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ�a���ݵ���غ��֪c��H����+c��Na����=c��CN����+c��OH����������Һһ����c��Na����+c��H����=c��OH����+c��CN��������a��ȷ��b���������غ��֪c��HCN��+c��CN����=0.1mol��L-1������c��HCN��+c��CN����=2c��Na��������b����c����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ������Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶ȣ���c��ȷ��d����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ��γɻ�����Һ������Һ��������������������ˮ�⣬�ٽ����룬�����������Ƶ���ٽ�ˮ�⣬��Һ����Ա仯����������Һ��pH�仯����d��ȷ����ѡb����5����ɫ����ΪCu(OH)2��CuS��s����Cu(OH)2��s�������ܣ������˳�����ת������Ӧ����ʽΪ��Cu2++2OH-
= (100a-1)��10-7 mol��L-1����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ�a���ݵ���غ��֪c��H����+c��Na����=c��CN����+c��OH����������Һһ����c��Na����+c��H����=c��OH����+c��CN��������a��ȷ��b���������غ��֪c��HCN��+c��CN����=0.1mol��L-1������c��HCN��+c��CN����=2c��Na��������b����c����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ�Ϻ����Һ��c��HCN��=0.05 mol��L-1��c��NaCN��=0.05 mol��L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ������Һ��ˮ�ĵ���̶�һ�����ڸ��¶��´�ˮ�ĵ���̶ȣ���c��ȷ��d����25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1��NaCN��HCN��Һ�������Ϻ��γɻ�����Һ������Һ��������������������ˮ�⣬�ٽ����룬�����������Ƶ���ٽ�ˮ�⣬��Һ����Ա仯����������Һ��pH�仯����d��ȷ����ѡb����5����ɫ����ΪCu(OH)2��CuS��s����Cu(OH)2��s�������ܣ������˳�����ת������Ӧ����ʽΪ��Cu2++2OH-![]() Cu(OH)2�� (7). Cu (OH)2(s)+S2-(aq)
Cu(OH)2�� (7). Cu (OH)2(s)+S2-(aq)![]() CuS(s)+2OH-(aq)
CuS(s)+2OH-(aq)


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��NaCl��MgSO4���ܽ�����ߣ�����˵����ȷ���ǣ� �� 
A.ֻ����t1��ʱ��NaCl��MgSO4���ܽ�Ȳ����
B.t1�桫t2�棬MgSO4���ܽ�����¶����߶���С
C.��t2��ʱ��MgSO4������Һ�����������������
D.��MgSO4������Һ���¶ȴ�t3�潵��t2��ʱ���о�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. Na2O2��NaClO��������ѧ��������ȫ��ͬ
B. ֻ�л��ý�������÷ǽ���Ԫ��֮������γ����Ӽ�
C. D2O��T2O����ͬ��Ԫ��
D. ������NaOH��Ӧ�Ĺ����У�ͬʱ�����Ӽ������Լ��ͷǼ��Լ��Ķ��Ѻ��γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ����������������֪A����̬�⻯������������������ˮ���ﷴӦ��Bԭ�������������ǵ��Ӳ�����3����C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��B��E����ͬһ���壮��ش��������⣺
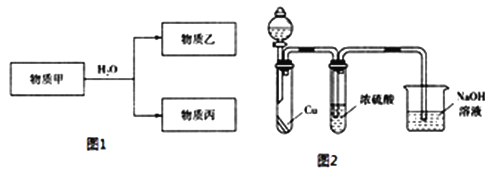
��1��E��Ԫ�����ڱ��е�λ����________
��2������Ԫ���γɵļ������У��뾶��С����________�������ӷ��ţ���
��3��������Ԫ���е�һ�ֻ�����ɵ����ʼ��Է�����ͼ1��Ӧ��
�����Ҿ���Ư���ԣ����ҵĵ���ʽΪ________��
��������ˮ��Һ��ǿ������Һ�����Ϊ______________���ѧʽ����
������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ����ҵ�����Ϊ________���õ��뷽��ʽ��ʾ����������ǿ�ᡢ��������ǿ���ԭ��________��
������������Ϊ����ɫ����ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ����Һ©����Ӧ����________�����Լ����ƣ���ʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���ɴ˵ó��Ľ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Դ�ǽ��������Ⱦ����Ҫ�ٴ룬���м״����Ҵ������鶼�����ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����C2H5OH(l)��3O2(g)��2CO2(g)��3H2O(g) ��H1����1366.8kJ/mol
��2CO(g)��O2(g)��2CO2(g) ��H2����566.0kJ/mol
��H2O(g)��H2O(l) ��H3����44 kJ/mol��
�Ҵ�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��______________________��
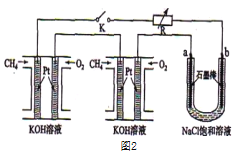
��2�������ü״�ȼ�շ�Ӧ���һ��ȼ�ϵ�ء�����ͼ1����Pt���缫���ϣ�������������Һ���������Һ���������缫�Ϸֱ����״���������
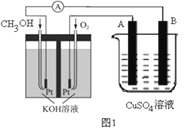
��д��ȼ�ϵ�ظ����ĵ缫��Ӧʽ_________________��
�������ø�ȼ�ϵ���ṩ��Դ����ͼ1�ұ��ձ������������������ͭ��������Ӧ��_______��(����A������B��)������������������6.4gʱ��ȼ�ϵ�������������ı�״�������Ϊ________L��
��3��ij�о�С�齫��������ȼ�ϵ�ش���������ͼ2��Ϊ��Դ�����б����Ȼ�����Һ���ʵ����ÿ����ؼ���ͨ����Ϊ1 L(��״��)���ҷ�Ӧ��ȫ����������ͨ�����صĵ�������ʽΪ_____________(�����ڳ���F��9.65��l04C/ mol)������ܲ������������Ϊ_____L(��״��)��
��4����ⷨ�������״���ˮ����ɵ���Ⱦ��ԭ���ǣ�ͨ�罫Co2+������������Co3+�����ɵ�Co3+���״�������CO2��H+(��ʯīϩ��ȥCo2+)��������ͼ3��ʾװ��ģ���������̣���Co2+�������ĵ缫��ӦʽΪ________________________��ȥ�״������ӷ���ʽΪ______________________________��
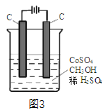
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ�������
A. ����������Һ��ϡ���ᷴӦ��Ba2++SO42��+H++OH��=BaSO4��+H2O
B. ��̼��þ�еμ�ϡ���CO32��+2H+=CO2��+H2O
C. ������ʯ��ˮ��ͨ�����������̼��Ca2++2OH��+CO2=CaCO3��+H2O
D. ��С�մ�����θ����ࣺHCO3��+H+=CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƚ����и������ʵķе㣬������ȷ����( )
�� ���飼�Ҵ� �� �����飾������ �� �Ҵ����Ҷ���
A.�٢�
B.�ڢ�
C.�٢�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.1molH2O������Ϊ18g/mol
B.CH4��Ħ������Ϊ16g
C.3.01��1023��SO2���ӵ�����Ϊ32g
D.��״���£�1mol�κ����������Ϊ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ����
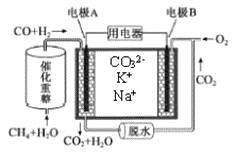
A. ��ӦCH4��H2O![]() 3H2��CO,ÿ����1molCH4ת��12mol e-
3H2��CO,ÿ����1molCH4ת��12mol e-
B. �缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2CO32��
C. ��ع���ʱ��CO32����缫B�ƶ�
D. �缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com