
【题目】Ⅰ.下图表示4个碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢结合。

(1)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成________和三键;不仅可以形成碳链,还可以形成碳环。
(2)上图中互为同分异构体的是:A与____;D与____,与B互为同分异构体但不属于同种类的物质的是_____。(填编号)
(3)写出F与溴水加成的反应方程式_________________。
Ⅱ.某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则该有机物可能的结构简式为______。
【答案】双键 C G H (CH3)2C=CH2+Br2→(CH3)2CBrCH2Br CH3(CH2)2CH3、CH3CH(CH3)CH3
【解析】
(1)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成碳碳双键和三键;不仅可以形成碳链,还可以形成碳环。
所以本题答案:双键;
(2)上图中A、C为饱和烷烃,且都含有四个碳原子,所以互为同分异构体;D、G都为含有四个碳原子的炔烃,所以互为同分异构体;B为含有四个碳原子的单烯烃,H为含有四个碳原子的环烷烃,两者的通式为CnH2n,所以B、H互为同分异构体,但不属于同种类的物质;所以本题答案:C;G;H ;
(3)由F的球棍模型可知,F为(CH3)2C=CH2,能与溴水发生加成反应,其反应的化学方程式为(CH3)2C=CH2 + Br2 →(CH3)2CBrCH2Br。答案:(CH3)2C=CH2 + Br2 →(CH3)2CBrCH2Br;
Ⅱ.某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L,烃的摩尔质量M=2.59g/L×22.4L/mol=58g/mol,即相对分子质量为58,烃分子中C原子数目为:(58×82.7%)/12=4,烃分子中H原子数目为(58×17.3%)/1=10,故某烃的分子式为:C4H10,可能的结构简式有CH3(CH2)2CH3、CH3CH(CH3)CH3;
因此,本题正确答案是: CH3(CH2)2CH3、CH3CH(CH3)CH3;


科目:高中化学 来源: 题型:
【题目】下列有关电池的叙述正确的是( )
A. 锌锰干电池工作一段时间后碳棒变细
B. 氢氧燃料电池可将热能直接转变为电能
C. 氢氧燃料电池工作时氢气在负极被氧化
D. 太阳能电池主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些物质的转化可用下图表示
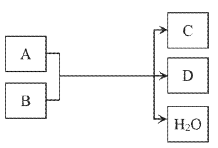
请回答下列问题
(1)完成反应方程式:
______Ca(OH)2+_____NaHCO3(过量)=______+_____+_______H2O,___________
(2)若A、C均含有铝元素:
①当B为盐酸时,C为___________;
②当B为NaOH时,C为___________。
(3)若A为第二周期黑色固体单质,B为第二周期某元素的最高价氧化物的水化物。写出该反应的化学方程式______________________。
(4)若A为过量铁粉、B为稀硝酸,检验溶液中金属阳离子的方法是___________。
(5)若C为能使湿润红色石蕊试纸变蓝的气体。实验室为了简便制取该气体,下列方法中适合的是___________
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气中加入铁触媒并加热至500℃
C.在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥
D.加热NH4HCO3,生成的气体用P2O5干燥
(6)若A为S单质,D为Na2SO3:
①Na2SO3溶液中各离子浓度由大到小的顺序为___________。
②C的浓溶液有臭鸡蛋气味,配制C溶液的方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药物的说法不正确的是( )
A.包装上印有“OTC”标识的为非处方药
B.氢氧化铝可作为治疗胃酸药的主要成分
C.阿司匹林具有解热镇痛的作用
D.青霉素是重要的抗生素,可以放心大量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是
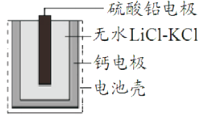
A. 放电时,电子由Ca电极流出
B. 放电时,Li+向PbSO4电极移动
C. 负极反应式:PbSO4+2e-+Li+=Li2SO4+Pb
D. 每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com