
【题目】某些物质的转化可用下图表示
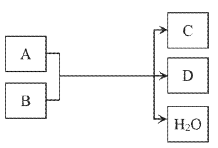
请回答下列问题
(1)完成反应方程式:
______Ca(OH)2+_____NaHCO3(过量)=______+_____+_______H2O,___________
(2)若A、C均含有铝元素:
①当B为盐酸时,C为___________;
②当B为NaOH时,C为___________。
(3)若A为第二周期黑色固体单质,B为第二周期某元素的最高价氧化物的水化物。写出该反应的化学方程式______________________。
(4)若A为过量铁粉、B为稀硝酸,检验溶液中金属阳离子的方法是___________。
(5)若C为能使湿润红色石蕊试纸变蓝的气体。实验室为了简便制取该气体,下列方法中适合的是___________
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气中加入铁触媒并加热至500℃
C.在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥
D.加热NH4HCO3,生成的气体用P2O5干燥
(6)若A为S单质,D为Na2SO3:
①Na2SO3溶液中各离子浓度由大到小的顺序为___________。
②C的浓溶液有臭鸡蛋气味,配制C溶液的方法是___________。
【答案】1,2,CaCO3↓,Na2CO3,2 AlCl3 NaAlO2 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 取反应后溶液,滴加到少量KMnO4溶液中,紫红色褪去 C c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+) 取Na2S固体溶解在浓NaOH溶液中,再加水稀释
CO2↑+4NO2↑+2H2O 取反应后溶液,滴加到少量KMnO4溶液中,紫红色褪去 C c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+) 取Na2S固体溶解在浓NaOH溶液中,再加水稀释
【解析】
(1)依据过量的碳酸氢钠和氢氧化钙反应方程式填写;
(2)若A、C均含有铝元素①当B为盐酸时,依据盐酸和铝反应可知,C为AlCl3;
②当B为NaOH时,C为NaAlO2。
(3)若A为第二周期黑色固体单质,则A为C,B为第二周期某元素的最高价氧化物的水化物,B为HNO3,;
(4)若A为过量铁粉、B为稀硝酸,则溶液中的金属阳离子是Fe2+,
(5)若C为能使湿润红色石蕊试纸变蓝的气体,则C为NH3;
(6)若A为S单质,D为Na2SO3;则反应为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O;
2Na2S+Na2SO3+3H2O;
①Na2SO3是强碱弱酸盐,在溶液中发生水解,溶液显碱性;
②C的浓溶液有臭鸡蛋气味,所以C是Na2S,配制该溶液是应防止其水解;
(1)过量的碳酸氢钠和氢氧化钙反应的方程式为:Ca(OH)2+2NaHCO3(过量)=CaCO3![]() +Na2CO3+2H2O;
+Na2CO3+2H2O;
本题答案为:1,2,CaCO3↓,Na2CO3,2。
(2)若A、C均含有铝元素①当B为盐酸时,依据盐酸和铝反应可知,C为AlCl3;
②当B为NaOH时,C为NaAlO2;
本题答案为:AlCl3 , NaAlO2。
(3)有分析知道,A是C,B是HNO3,则反应方程式为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
本题答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(4)若A为过量铁粉、B为稀硝酸,则溶液中的金属阳离子是Fe2+,检验Fe2+的方法是:取反应后溶液少许于试管中,滴加到少量KMnO4溶液中,紫红色褪去;
本题答案为:取反应后溶液,滴加到少量KMnO4溶液中,紫红色褪去。
(5)若C为能使湿润红色石蕊试纸变蓝的气体,则C为NH3,实验室制取NH3的简便方法是:在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥;
本题答案为:C。
(6)若A为S单质,D为Na2SO3;则反应为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O;
2Na2S+Na2SO3+3H2O;
①Na2SO3是强碱弱酸盐,在溶液中发生水解,溶液显碱性,Na2SO3溶液中各离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+);
本题答案为:c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+)。
②C的浓溶液有臭鸡蛋气味,是因为Na2S水解产生H2S的原因,配制该溶液时应加入氢氧化钠抑制其水解,所以取Na2S固体溶解在浓NaOH溶液中,再加水稀释,来配制Na2S溶液;
本题答案为:取Na2S固体溶解在浓NaOH溶液中,再加水稀释。


科目:高中化学 来源: 题型:
【题目】下列有关原子的说法正确的是
①原子是由核外电子和原子核构成的 ②原子不能再分 ③原子是化学变化中最小的粒子 ④原子的质量主要集中在原子核上
A.①②B.①③④C.①②③D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明有关物质的性质,某学生设计了如图所示的装置。当打开活塞C,使A中液体与H中的搁板上的固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮。

(1)请写出该装置中有关仪器内盛放的物质的化学式:A___B___F_____;
(2)用化学方程式表示上述实验仪器中发生的有关反应:
H中:____;F中:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用H3R表示)可用作酸洗剂。常温下,向0.1mol·L1 H3R溶液中加入少量的NaOH固体(忽略溶液体积的变化),H3R、H2R、HR2和R3的含量与pH的关系如图所示。下列正确的是
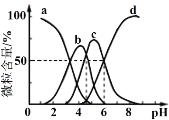
A. 图中b曲线表示HR2的变化
B. HR2的电离常数Ka3=106
C. pH=7时,c(Na+)=c(H2R)+c(HR2)+c(R3)
D. pH=5时,c(H2R)+c(HR2)+c(R3)=0.1mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为___________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为___________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(部分夹持装置未画出)。

①仪器A的名称为___________,装置乙中装入的试剂___________,装置B的作用是___________。
②装置丙分液漏斗中盛装的最佳试剂是___________(选填字母)。
A.蒸馏水 B.10.0mol·L-1浓盐酸 C浓氢氧化钠溶液 D饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL0.5000mol· L-1 NaoH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L-1标准HCl滴定至终点,重复实验三次取平均值,消耗10.00mL。达到滴定终点的现象为___________,产品的纯度为___________。
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)
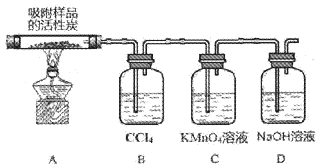
①加热时A中试管出现黄绿色,装置B的作用是___________
②装置C中的现象是___________,反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图表示4个碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢结合。

(1)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成________和三键;不仅可以形成碳链,还可以形成碳环。
(2)上图中互为同分异构体的是:A与____;D与____,与B互为同分异构体但不属于同种类的物质的是_____。(填编号)
(3)写出F与溴水加成的反应方程式_________________。
Ⅱ.某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则该有机物可能的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示正确的是( )
A.图 表示反应2SO2(g)+O2(g)
表示反应2SO2(g)+O2(g) ![]() 2SO3(g)在t1时刻增大O2的浓度对反应速率的影响
2SO3(g)在t1时刻增大O2的浓度对反应速率的影响
B.图 表示反应N2 (g)+3H2(g)
表示反应N2 (g)+3H2(g)![]() 2NH3(g)在t1时刻加入催化剂后对反应速率的影响
2NH3(g)在t1时刻加入催化剂后对反应速率的影响
C.图 表示中和热测定的实验装置图
表示中和热测定的实验装置图
D.图 中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g);ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g);ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com