
【题目】25C时,有关弱酸的电离平衡常数如下表:
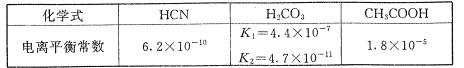
下列有关微粒浓度的说法正确的是( )
A.pH均为8的NaCN溶液、Na2CO3溶液、CH3COONa溶液:c(Na2CO3)>c(NaCN)>c(CH3COONa)
B.浓度均为0.1mol/LNaHCO3和Na2CO3混合溶液中:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
C.0.2mol/LHCN溶液与0.lmol/LNaOH溶液等体积混合所得溶液中:c(HCN)>c(Na+)>c(CN-)>c(OH-)
D.浓度均为0lmol/LCH3COOH和CH3COONa混合溶液中:c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-)
【答案】BC
【解析】
A.酸的电离平衡常数越大,电离程度越大,则酸根离子的水解程度越小,当盐溶液的pH相同时,浓度越大,电离平衡常数:CH3COOH>HCN>HCO3—,则水解程度CO32—>CN—>CH3COO—,所以c(Na2CO3)<c(NaCN)<c(CH3COONa),A选项错误;
B.根据物料守恒可得,浓度均为0.1mol/LNaHCO3和Na2CO3混合溶液中:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),B选项正确;
C.0.2mol/LHCN溶液与0.lmol/LNaOH溶液等体积混合所得溶液为NaCN和HCN的混合溶液,由于NaCN的水解大于HCN的电离,故有c(HCN)>c(Na+)>c(CN-)>c(OH-),C选项正确;
D。浓度均为0.1mol/LCH3COOH和CH3COONa混合溶液中,醋酸根离子水解程度较小,则c(CH3COOH)+c(H+)<c(CH3COO-)+c(OH-),D选项错误;
答案选BC。


科目:高中化学 来源: 题型:
【题目】常温下,向 20 mL 0.1 mol·L-1(NH4)2SO4 溶液中逐滴加入 0.2 mol·L-1NaOH 溶液时,溶液的 pH与所加 NaOH 溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是
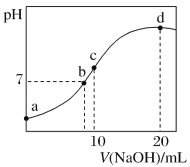
A.点 a 所示溶液中:c(NH![]() )>c(SO
)>c(SO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.点 b 所示溶液中:c(NH![]() )=c(Na+)>c(H+)=c(OH)
)=c(Na+)>c(H+)=c(OH)
C.点 c 所示溶液中:c(SO![]() )+c(H+)=c(NH3·H2O)+c(OH)
)+c(H+)=c(NH3·H2O)+c(OH)
D.点 d 所示溶液中:c(SO![]() )>c(NH3·H2O)>c(OH-)>c(NH
)>c(NH3·H2O)>c(OH-)>c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了_____的作用力;二氧化硅熔化,粒子间克服了_____的作用力;碘的升华,粒子间克服了_____的作用力。三种晶体的熔点由高到低的顺序是_____。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为_____ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,五种物质的熔点由高到低的顺序是_____。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(5)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A_____;B_____;C_____;D_____。
A.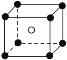 B.
B.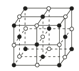 C.
C.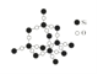 D.
D.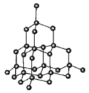
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年度诺贝尔化学奖授予在锂离子电池发展做出贡献的三位科学家。某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。下列有关该电池的说法不正确的是( )
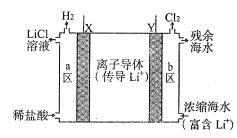
A.该装置可在提取LiCl溶液的同时得电能
B.电子由Y极通过外电路移向X极
C.正极发生的反应为:2H++2e—===H2↑
D.Y极每生成22.4LCl2,有2molLi+从b区移至a区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中将含有较多Ca2+、Mg2+的水称为硬水。测定某水域的钙硬度、镁硬度(每升水中含Ca2+或Mg2+的质量,单位mg/L)的过程如下:
①取50.00mL水样,控制溶液的pH=10。以铬黑T为指示剂,用0.01000mol/LEDTA标准溶液滴定硬水中钙和镁的总含量至终点,消耗EDTA标准溶液30.00mL。
②另取50.00mL水样,加入10%NaOH溶液至pH=12.5,加入钙指示剂,用001000mol/LEDTA标准溶液滴定硬水中钙的含量至终点,消耗EDTA标准溶液20.00mL。
已知:Ca2+、Mg2+与EDTA反应的化学汁量比均为1:1。
(1)向硬水中加入石灰,可使Ca2+、Mg2+沉淀,以达到软化硬水的目的,写出Ca(OH)2和Ca(HCO3)2反应的化学方程式:___。
(2)“加入10%NaOH溶液至pH=12.5”的目的是___。
(3)计算该水样的钙硬度、镁硬度(写出计算过程)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。
(2)酸浸净化后的废铁屑:将2gFe粉、10mL3mol·L-1的H2SO4溶液加入烧瓶中反应,用如图所示装置制备FeSO4溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。
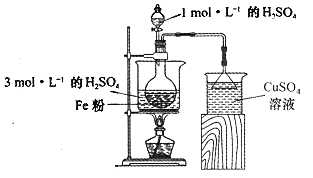
①反应过程中会产生少量H2S、PH3等气体,需使用封闭装置。写出用CuSO4溶液吸收H2S气体的化学反应方程式:____________________________
②反应过程中使用过量铁粉的目的是____________________________
(3)制备(NH4)2Fe(SO4)2·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。
A.通入过量Cl2:Fe2+、H+、NH4+、Clˉ、SO42ˉ
B.加入过量KSCN溶液:K+、NH4+、Fe3+、SO42ˉ、SCNˉ
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42ˉ、OHˉ
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42ˉ、Clˉ、ClOˉ、OHˉ
(4)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。重复上述操作2次实验结果如下:

该产品的纯度为____________________________(用含a、c的代数式表示)。
有同学提出,测定产品中SO42ˉ的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2mol·L-1的HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸反应的实验改进装置如图所示,下列说法错误的是
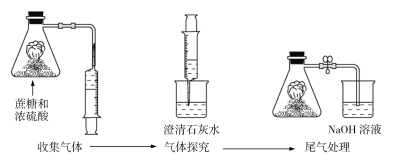
A.改进装置后,有毒气体被碱液吸收,实现了绿色环保
B.浓硫酸在实验过程中体现了脱水性和强氧化性
C.产生的气体能使澄清石灰水变浑浊,说明产生了CO2
D.该反应比较剧烈、危险,实验各物质的用量应按要求规范操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
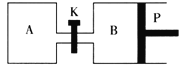
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.27 | 0.012 |
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com