
【题目】把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)== nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.03mol·L﹣1·min﹣1,计算:
(1)n的值为____;
(2)前5min内用X表示的反应速率_____;
(3)5min末Y的浓度_______。
【答案】3 0.03mol·L-1·min-1 0.15mol·L-1
【解析】
根据反应速率与化学计量数间的关系分析解答;根据速率表达式进行相关计算。
(1)Z浓度变化来表示的平均速率为 0.03molL﹣1min﹣1,则Z的物质的量变化为:0.03molL﹣1min﹣1×2L×5min=0.3mol,根据物质的量之比等于计量数之比可知,n:2=0.3mol:0.2mol,解得n=3;
(2)Z与X的化学计量数都是3,则前5min内用X表示的反应速率与Z表示的反应速率相等,都是0.03mol·L-1·min-1;
(3)5min内Z的物质的量变化为:0.03molL﹣1min﹣1×2L×5min=0.3mol,根据反应3X(g)+Y(g)═3Z(g)+2W(g)可知5min末总共消耗Y的物质的量为:0.3mol×1/3![]() =0.1mol,则5min末剩余Y的物质的量为:0.4mol﹣0.1mol=0.3mol,所以5min末Y的物质的量浓度为:0.3mol/2L=0.15mol·L-1.
=0.1mol,则5min末剩余Y的物质的量为:0.4mol﹣0.1mol=0.3mol,所以5min末Y的物质的量浓度为:0.3mol/2L=0.15mol·L-1.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+ 电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第________ 周期________ 族.
(2)Z元素的符号是 ________ ,其在自然界中常见的二元化合物是________ (写化学式) .
(3)X与M的单质在高温下反应的化学方程式为________,产物分子为直线形,其化学键属___ 共价键(填“极性”或“非极性”).
(4)四种元素中的________(写名称) 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为_____,B在周期表中的位置____。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146g·mol-1,该物质的化学式为___。已知DBn 在温度高于45度时为气态。DBn属于____晶体。
(3)C与氢元素组成1:1的化合物,与水发生剧烈反应生成一种气体,写出该反应化学反应方程式_______。
(4)D元素的+4价含氧酸钠盐,该钠盐在空气中容易变质,设计实验方案证明该盐已经变质____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以A为主要原料来合成乙酸乙酯,其合成路线如下图所示。其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平。又知2CH3CHO+O2![]() 2CH3COOH。请回答下列问题:
2CH3COOH。请回答下列问题:
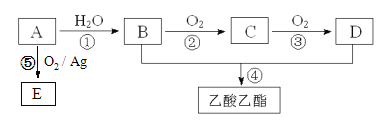
(1)写出A的电子式________________________。
(2)B、D分子内含有的官能团分别是________、________(填名称)。
(3)写出下列反应的反应类型:①______________,④______________。
(4)写出②反应的化学方程式: _______________________;
(5)E是C的同分异构体,其结构简式为___________;传统生产E的方法是氯代乙醇法,先生产2-氯乙醇,再与Ca(OH)2反应制得。与传统方法相比采用反应⑤的优势在于_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较中,正确的是
A. 原子半径K< Na B. 酸性H2CO3< H2SO4
C. 稳定性HF< HCI D. 碱性NaOH< Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲烷的燃烧热为890.3 kJmol-1。氢气的燃烧热为285.8 kJmol-1。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2 kJ,则该混合气体中甲烷和氢气的物质的量比为( )
A. 1∶8 B. 8∶1 C. 4∶17 D. 17∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,发生反应2HI(g)![]() H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
A. 平衡时,各容器的压强:②=①=③
B. 平衡时,I2的浓度:②>①=③
C. 平衡时,I2的体积分数:②>①=③
D. 从反应开始到达平衡的时间:①>②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
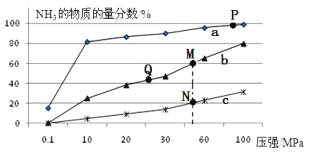
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com