
����Ŀ����ҵ����AΪ��Ҫԭ�����ϳ�������������ϳ�·������ͼ��ʾ������A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����֪2CH3CHO+O2![]() 2CH3COOH����ش��������⣺
2CH3COOH����ش��������⣺
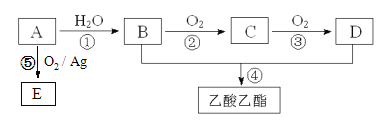
��1��д��A�ĵ���ʽ________________________��
��2��B��D�����ں��еĹ����ŷֱ���________��________�������ƣ���
��3��д�����з�Ӧ�ķ�Ӧ���ͣ���______________����______________��
��4��д���ڷ�Ӧ�Ļ�ѧ����ʽ�� _______________________��
��5��E��C��ͬ���칹�壬��ṹ��ʽΪ___________����ͳ����E�ķ������ȴ��Ҵ�����������2-���Ҵ�������Ca(OH)2��Ӧ�Ƶá��봫ͳ������Ȳ��÷�Ӧ�ݵ���������_________________��
���𰸡�![]() �ǻ��Ȼ��ӳɷ�Ӧȡ����Ӧ����������Ӧ���֣�
�ǻ��Ȼ��ӳɷ�Ӧȡ����Ӧ����������Ӧ���֣�![]()
![]() ԭ��������Ϊ100%
ԭ��������Ϊ100%
��������
A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����AΪCH2=CH2����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����BΪ�Ҵ���B��D��Ӧ����������������DΪ���ᣬCΪ��ȩ��
��1��A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����AΪCH2=CH2��������̼ԭ����̼ԭ��ͨ�����Թ��õ��Ӷ������ӣ�̼ԭ������ԭ��ͨ��һ�Թ��õ��Ӷ������ӣ����Ե���ʽΪ![]() ��
��
��2��BΪCH3CH2OH��DΪCH3COOH����B�й��������ǻ���D�й��������Ȼ���
��3����һ�������£���ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����Ũ���������������������£��Ҵ������ᷢ��������Ӧ����ȡ����Ӧ����������������
��4����ͭ���������������������£��Ҵ�����������������ȩ����Ӧ����ʽΪ��![]() ��
��
��5��E��C��ͬ���칹��������ʽ��ͬ���ṹ��ͬ����E�Ľṹ��ʽΪ��![]() ����ͳ����E�ķ������ȴ��Ҵ�����������2-���Ҵ�������Ca(OH)2��Ӧ�Ƶã���Ӧ���ղ����
����ͳ����E�ķ������ȴ��Ҵ�����������2-���Ҵ�������Ca(OH)2��Ӧ�Ƶã���Ӧ���ղ����![]() �⣬�����Ȼ��ƣ���ʹ�÷�Ӧ���Ʊ�
�⣬�����Ȼ��ƣ���ʹ�÷�Ӧ���Ʊ�![]() ��û���������ԭ��������Ϊ100%��
��û���������ԭ��������Ϊ100%��


 ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4mol KNO3��2.5mol H2SO4��ijϡ��Һ�м���1.5mol��,��ַ�Ӧ��,�����������ڱ�״���µ����Ϊ( )
A. 33.6LB. 28LC. 22.4LD. 11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˽�һ�����Ʊ��������Ļ���������������������ȷ����
A���ƹ�ʹ������ϴ�·�
B��ʹ�����ȼ�ϵĹ�����
C�����ٺ���ʯȼ�ϵĴ���ȼ��
D��ʹ�ò������һ�������ϲ;�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�����2L�ܱ������ڽ�����ijһ��Ӧ��X���塢Y��������ʵ����淴Ӧʱ��仯��������ͼ��������������ȷ���ǣ� ��
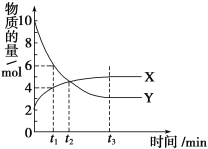
A. ��Ӧ�Ļ�ѧ����ʽΪ3X(g)![]() 7Y(g)
7Y(g)
B. t1ʱ��Y��Ũ����XŨ�ȵ�1.5��
C. t2ʱ�������淴Ӧ�������
D. 0��t1ʱ����ڣ�Y��ƽ����Ӧ����Ϊ4/t1mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����ij�����(R-Br)�е���Ԫ�أ�������ʵ�������
�ټ�����У��ڼ���AgNO3��Һ����ȡ����±�������ܼ���ϡ�����ữ���ݼ���NaOH��Һ������ȴ����ȷ�������Ⱥ�˳����( )
A.�ۢݢ٢ޢܢ�B.�ۢݢ٢ޢڢ�C.�ۢ٢ݢޢڢ�D.�ۢ٢ڢޢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6mol X�����0.4mol Y��������2L�����У�������Ӧ��3X��g��+Y��g��== nZ��g��+2W��g����5minĩ������0.2mol W������֪��ZŨ�ȱ仯����ʾ��ƽ������Ϊ0.03mol��L��1��min��1�����㣺
��1��n��ֵΪ____��
��2��ǰ5min����X��ʾ�ķ�Ӧ����_____��
��3��5minĩY��Ũ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ȵ������ҵ��µĴ�л�����ۺ�֢���Ը�Ѫ��Ϊ��Ҫ��־���������������ʳƷ��ȱ���˶�����������
��1��Ѫ����ָѪҺ�е�������(C6H12O6)������˵����ȷ����________��
A������������̼ˮ����������ʽ�ɱ�ʾΪC6(H2O)6����ÿ�������Ƿ����к�6��H2O
B�����������Ǹߣ��������Ƶ�������ͭ����Һ����ⲡ����Һ�е�������
C��������Ϊ�����ṩ����
D������ˮ������ղ�����������
��2��ľ�Ǵ�[CH2OH(CHOH)3CH2OH]��һ����ζ����������ʳ�ú�Ѫ�Dz������ߡ���Ԥ��ľ�Ǵ���һ�ֻ�ѧ���ʣ�___________________________________________________��
��3�������˲������ƣ��ƾ��ڸ����ڿɱ�ת�����л���A��A���й�����ʵ�������£�
��.ͨ����Ʒ�����ײ��A����Է�������Ϊ60��
��.�˴Ź�����ԭ�ӹ����ܶ��л��������ͬЧ��ԭ�Ӹ�����ͬ�ķ�ֵ(�ź�)�����ݷ�ֵ(�ź�)����ȷ����������ԭ�ӵ��������Ŀ�����磺�Ҵ�(CH3CH2OH)��������ԭ��(ͼ��)�����ⶨ���л���A�ĺ˴Ź�������ʾ��ͼ��ͼ����ʾ��

��.��A����ˮ������ʯ����Һ��������Һ��졣��д��A�Ľṹ��ʽ��_________________________________________________��
��4���������˶���߲˺Ͷ���ʳƷ���߲��и�����ά�أ�����ʳƷ�и��������ʡ�����˵���������________(�����)��
A�������ʶ�������Ȼ�л��߷��ӻ�����Ҷ�������ˮ
B������������ζ�ķ�����������ϳ���ά����ë
C�������ڲ�����ά��ˮ��ø���˲���������ά�أ�����߲��е���ά�ض���û���ô�
D�������ߡ�ҽ�þƾ���ɱ������������Ϊ������ʹϸ���ĵ����ʱ���
E������Ȼ�����Ƴ���������ɼ���Ⱦ�϶�����ĸ�����
��5���㽶���ڸ���ˮ���������˲���ʳ�á���ϩ���㽶�Ĵ����������ʹ������Ȼ�̼��Һ��ɫ����д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������Ⱦɫ����ͷ���������ʻƸ���Ǧ(PbCrO4)��ʹ�����°����ѱ����Ľ��á���֪��Ԫ��(Cr)���ϼ�Ϊ��6�ۣ���ǦԪ��(Pb)�Ļ��ϼ�Ϊ(����)
A.��1B.��2C.��3D.��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���һֱ�ǻ�ѧ�������о����ȵ�֮һ��
�������ڵ�п��Ŧ��ʽ��أ���п��������Ϊ�缫���ϣ�����������ҺΪ���Һ��ԭ��أ���Ч�Ľ�����ʹ��������������©Һ�����⡣
����ܷ�ӦΪ��Zn+HgO = ZnO+Hg��
��1���õ�ص�������Ӧʽ��___________��
��2�����Ǹù�������ˮ�лẬ��һ������+2�۵Ĺ����ӣ�ͨ����������ˮ��ͨ��һ���������⣬��Ӧ�����ӷ���ʽΪ___________��
��3���÷�����ȱ���Dz���Ŀ����Ƚ�С������������ˮ�У�ͨ������Ͷ��һ����������������к����������������ԭ��___________��
II������ӵ��������㡢����������ŵ㣬��Ϊ���������Ϊ�����ĵ�ء����е���Ҫ������������ﮣ�LiFePO4��ͨ�������������̽���������
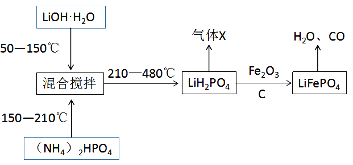
��ش��������⣺
��4����������������Ͻ�������Ŀ����__________������X����ˮ����֮�⣬������___________����д��ѧʽ����
��5����д��һ����������LiH2PO4����LiFePO4�Ļ�ѧ����ʽ__________��������1mol���������ʱ��ת�Ƶĵ�����ĿΪ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com