
【题目】下表是几种常见弱酸的电离平衡常数(25℃ )
化学式 | H2CO3 | CH3COOH | HClO |
电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 3.0×10-8 |
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是_____________________________________。
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+)B.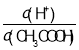 C.c(H+)c(OH﹣)D.
C.c(H+)c(OH﹣)D.![]() E.
E.![]()
(3)25℃时,等浓度的Na2CO3、CH3COONa和NaClO三种溶液的pH从小到大依次是_____________________________________。
(4)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,溶液中离子浓度大小关系:_________________
(5)下列反应不能发生的是______(填字母)。
a.![]() +2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.![]() +2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=
+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=![]() +2HClO
+2HClO
【答案】CH3COOH>H2CO3>HClO BD CH3COONa﹤NaClO﹤Na2CO3 c(![]() )=c(Cl-)>c(OH-)=c(H+) cd
)=c(Cl-)>c(OH-)=c(H+) cd
【解析】
(1)比较H2CO3(K1)、CH3COOH、HClO三种酸的电离常数,便可得出酸性强弱。
(2)在CH3COOH溶液中,存在下列电离平衡:CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() H++OH-。
H++OH-。
A.加水稀释,c(H+)不断减小;
B.加水稀释,n(H+)增大,n(CH3COOH)减小, =
=![]() ;
;
C.c(H+)c(OH﹣)=KW;
D.加水稀释,c(H+)减小,c(OH-)增大;
E.![]() =Ka
=Ka
(3)25℃时,比较等浓度的Na2CO3、CH3COONa和NaClO三种溶液的pH,可比较对应的三种酸的酸性。
(4)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,则醋酸过量,可利用电荷守恒进行分析。
(5)利用强酸制弱酸的原理分析反应发生的可能性。
(1)根据分析表格中数据可知,K(CH3COOH)> K1>K(HClO),所以三种酸的酸性从强到弱依次是CH3COOH>H2CO3>HClO。答案为:CH3COOH>H2CO3>HClO;
(2)A.加水稀释,c(H+)不断减小,A不合题意;
B.加水稀释,n(H+)增大,n(CH3COOH)减小, =
=![]() 变大,B符合题意;
变大,B符合题意;
C.常温下,c(H+)c(OH﹣)=KW,加水稀释,KW不变,C不合题意;
D.加水稀释,c(H+)减小,c(OH-)增大,![]() 增大,D符合题意;
增大,D符合题意;
E.常温下,![]() =Ka,加水稀释,Ka不变,E不合题意;
=Ka,加水稀释,Ka不变,E不合题意;
故选BD。答案为BD;
(3)25℃时,K(CH3COOH) >K(HClO)> K2,所以等浓度的Na2CO3、CH3COONa和NaClO的碱性Na2CO3>NaClO>CH3COONa,三种溶液的pH从小到大依次是CH3COONa﹤NaClO﹤Na2CO3。答案为:CH3COONa﹤NaClO﹤Na2CO3;
(4)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,依据电荷守恒可得:c(![]() )+c(H+)=c(Cl-)+c(OH-),由于c(H+)=c(OH-),所以c(
)+c(H+)=c(Cl-)+c(OH-),由于c(H+)=c(OH-),所以c(![]() )=c(Cl-),从而得出溶液中离子浓度大小关系:c(
)=c(Cl-),从而得出溶液中离子浓度大小关系:c(![]() )=c(Cl-)>c(OH-)=c(H+)。答案为:c(
)=c(Cl-)>c(OH-)=c(H+)。答案为:c(![]() )=c(Cl-)>c(OH-)=c(H+);
)=c(Cl-)>c(OH-)=c(H+);
(5)a.因为K(CH3COOH)> K1,所以![]() +2CH3COOH=2CH3COO-+CO2↑+H2O能发生;
+2CH3COOH=2CH3COO-+CO2↑+H2O能发生;
b.因为K(CH3COOH)>K(HClO),所以ClO-+CH3COOH=CH3COO-+HClO能发生;
c.因为K(HClO)< K1,所以![]() +2HClO=CO2↑+H2O+2ClO-不能发生;
+2HClO=CO2↑+H2O+2ClO-不能发生;
d.因为K(HClO)>K2,所以2ClO-+CO2+H2O=![]() +2HClO不能发生;
+2HClO不能发生;
故选cd。答案为:cd。


科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
A.a与电源负极相连,发生还原反应
B.每处理lmolNO可以生成2molA
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2:5通入装置可彻底转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )

A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电时正极反应为NiOOH(s)+H2O(l)+e-=Ni(OH)2(s)+OH-(aq)
C.放电时负极反应为Zn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)
D.放电过程中OH-通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.T℃时,pH=7的溶液一定呈中性
B.已知反应2NO2(g)![]() N2O4(g)在低温下可自发进行,则△H>0
N2O4(g)在低温下可自发进行,则△H>0
C.在0.1molL-1的NH4Cl溶液中:c(NH4+)+c(NH3H2O)=0.1molL-1
D.在Na2CO3溶液中:c(Na+)=2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时的浓度变化情况,则下列说法错误的是( )

A.发生的反应可表示为2A(g)![]() 3B(g)+C(g)
3B(g)+C(g)
B.前2min,A的分解速率为0.1mol·L-1·min-1
C.2min后反应达到平衡状态
D.2min时,A、B、C的浓度之比为2:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
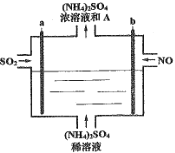
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
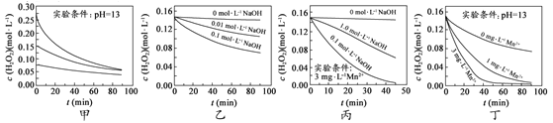
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒“现代工业的味精”,是发展现代工业、现代国防和现代科学技术不可缺少的重要材料,其氧化物二氧化钒(VO2)是一种新型热敏材料,五氧化二钒(V2O5)是接触法生成硫酸的催化剂.下列某化学小组从废钒催化剂(V2O5、V2O4、K2SO4、SiO2、Fe2O3、Al2O3等)中回收V2O5并且利用回收的V2O5制备VO2的氧钒(Ⅳ) 碱式碳酸铵晶体
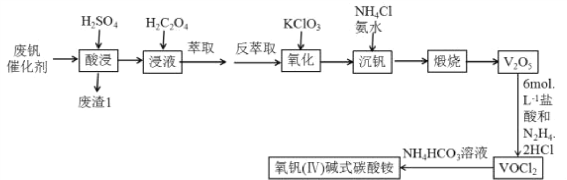
已知:①“酸浸”时V2O5转化为VO2+,V2O4转成VO2+
②有机萃取剂萃取VO2+的能力比萃取VO2+要强。
③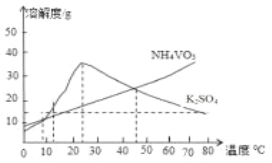
回答下列问题:
(1)写出“废渣1”的主要成分的用途________(填两条)。
(2)“萃取”之前加入H2C2O4的主要目的_____________________。
(3)“氧化”过程中发生的离子方程式___________________________。
(4)该工艺中加入氯化铵“沉钒”是回收钒的关键之一,加入氯化铵、氨水之后的操作是____________,该流程用到了过滤操作,过滤和萃取分液都需用到的一种玻璃仪器是__________。
(5)工艺中生成VOC12的同时生成一种无色无污染的气体,该反应中氧化产物与还原产物的物质的量之比为___________;也可只用浓盐酸与V2O5来制备VOC12 溶液,该方法的化学方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com