
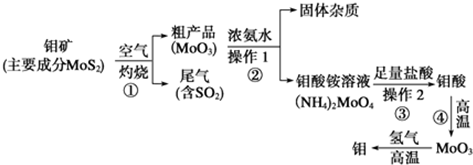
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤一:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤二:在A试管中滴加 | 若 |
| 步骤三:在B试管中滴加 | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地壳中含量最多的金属元素是Al |
| B、金属一般是热和电的良导体 |
| C、自然界中绝大多数金属元素以游离态的形式存在 |
| D、金属一般呈银白色具有金属光泽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( ) | 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 金属氧化物 | 碱性氧化物 | 氧化物 |
| D | 离子化合物 | 电解质 | 化合物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
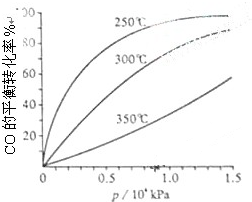 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com