
 如图所示装置是碳酸钠和碳酸氢钠的热稳定性的比较试验,回答下列问题
如图所示装置是碳酸钠和碳酸氢钠的热稳定性的比较试验,回答下列问题

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
| A、原子半径:W>Z>Y>X |
| B、Y 元素在周期表中的位置为第三周期第ⅡA 族 |
| C、丁的稳定性大于甲烷 |
| D、0.1 mol?L-1 甲的水溶液中,由水电离产生的c(H+)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只生成CaHPO4溶液 |
| B、有Ca3(PO4)2和CaHPO4生成 |
| C、只生成Ca(H2PO4)2溶液 |
| D、有CaHPO4和Ca(H2PO4)2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
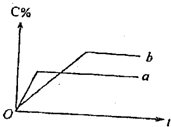 如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )
如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b表示没有使用催化剂 |
| B、其他条件相同,若只改变温度,则a比b的温度高且正反应吸热 |
| C、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D、其他条件相同,若只改变A物质的量,则a比b用A物质的量少 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛.| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com