
����Ŀ�����Ͻ���и�Ӳ�ȡ���ʴ���ԣ��㷺Ӧ���ھ����������죬�ɸ�̼�����Ͻ������ȡ���ļ���������:
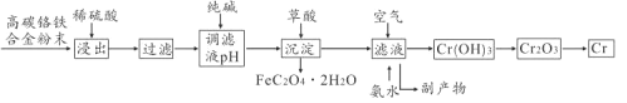
��֪:Cr+H2SO4=CrSO4+H2��
��ش���������:
��ش���������:
��1��ϡ������������У���������������Ĵ�ʩ��_____ (дһ������)
(��֪: ![]() )
)
��2���ô��������Һ��ȣ����������������ܵ��µĺ����______����������������Ҫ���ʵĻ�ѧʽΪ_____________
��3��������ᷢ����Ӧ�����ӷ���ʽΪ______���������ȷ�Ӧұ��������д���÷�Ӧ�Ļ�ѧ����ʽ_________
��4������Һ��ͨ����������백ˮ������Ӧ�Ļ�ѧ����ʽΪ_________
��5��������ͼװ�ã�̽���������Ļ�����ǿ����
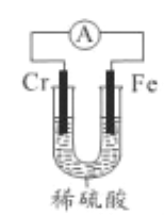
��֤�����ȸ����õ�ʵ��������______����ҵ�ϣ��ڸ����߱���Ƹ����������(CrSO4)��Һ�����Һ�������ĵ缫��ӦʽΪ___________��
��6����֪��̼��������������Ԫ��������Ϊ14:13.������������Ԫ��ת������������������Ϊ80%����������ȡ����������ת����Ϊ95%������õ���������Ʒ��(FeC2O4��2H2O)����Ϊ18.00�֣������ұ����������Ϊ____��(�������1λС��)��
���𰸡����ȡ����衢�ʵ����ϡ����Ũ�ȵ�(�𰸺�������) Cr2+��Fe2+ˮ������ Na2SO4��NaHSO4 Fe(OH)2+H2C2O4=FeC2O4��2H2O�� Cr2O3+2Al![]() Al2O3+2Cr 4CrSO4+O2+8NH3��H2O+2H2O=4Cr(OH)3��+4(NH4)2SO4 �����ϲ������� Cr2++2e-=Cr 6.2
Al2O3+2Cr 4CrSO4+O2+8NH3��H2O+2H2O=4Cr(OH)3��+4(NH4)2SO4 �����ϲ������� Cr2++2e-=Cr 6.2
��������
��1����֪:![]() ��ϡ������������У���������������Ĵ�ʩ���Ǽӿ컯ѧ��Ӧ���ʣ����Ӱ�컯ѧ��ѧ��Ӧ���ʵ����ؽ����ܽᣬ�����ȡ�������ʵ����ϡ����Ũ�ȵ���
��ϡ������������У���������������Ĵ�ʩ���Ǽӿ컯ѧ��Ӧ���ʣ����Ӱ�컯ѧ��ѧ��Ӧ���ʵ����ؽ����ܽᣬ�����ȡ�������ʵ����ϡ����Ũ�ȵ���
��2���ô��������Һ��ȣ��������������ΪCO32-ˮ���Լ��ԣ�����ܵ���Cr2+��Fe2+���������ݷ�Ӧ����ͼ����������������Ҫ���ʵĻ�ѧʽΪNa2SO4 (NH4)2SO4
��3��������ᷢ����Ӧ�����ӷ���ʽΪFe(OH)2+H2C2O4=FeC2O4��2H2O�����������ȷ�Ӧָ�ý������ͽ��������ﷴӦұ�����������ȷ�Ӧұ�����Ļ�ѧ��Ӧ����ʽCr2O3+2Al![]() Al2O3+2Cr ��
Al2O3+2Cr ��
��4������Һ��ͨ����������백ˮ������Ӧ�Ļ�ѧ����ʽΪ4CrSO4+O2+8NH3��H2O+2H2O=4Cr(OH)3��+4(NH4)2SO4
��5����װ��ͼ������װ��Ϊԭ��أ����������缫���ϣ������Ϊϡ���ᣬ����ԭ��ع���ԭ�������ý�����������������������ʧ���ӣ�������������Һ��H+�õ����������������Ը����ϲ������ݣ�˵�����Ľ��������Աȸ�ǿ���ڸ����߱���Ƹ������������������������(CrSO4)��Һ�����Һ�������ĵ缫��ӦʽΪCr2++2e-=Cr��
��6������֪��(FeC2O4��2H2O)�����ʵ���Ϊ(18![]() 6g)/180g.mol-1=105mol
6g)/180g.mol-1=105mol
��Ԫ��ת������������������Ϊ80%,���Ի���������ĺ���Ϊ105mol/80%=1.25![]() 105 mol��֪��̼��������������Ԫ��������Ϊ14:13.��˵������ԭ�Ӹ�����Ϊ1:1�����Ի�����и��ĺ���Ϊ1.25
105 mol��֪��̼��������������Ԫ��������Ϊ14:13.��˵������ԭ�Ӹ�����Ϊ1:1�����Ի�����и��ĺ���Ϊ1.25![]() 105 mol�������з�������ȡ����������ת����Ϊ95%������ұ����������Ϊ1.25
105 mol�������з�������ȡ����������ת����Ϊ95%������ұ����������Ϊ1.25![]() 105 mol
105 mol![]() 52g.mol-1= 6.2
52g.mol-1= 6.2![]() 6g=6.2����
6g=6.2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ѫ��[�����軯�أ�K4Fe(CN)6]Ŀǰ�㷺����ʳ�����Ӽ�������������ҹ��������涨ʳ���л�Ѫ�ε����ʹ����Ϊ10mg��kg-1��һ���Ʊ���Ѫ�εĹ������£�

�ش��������⣺
��1�������Ӧ�Ļ�ѧ����ʽΪ_____________________________��
��2��������������õķ�Һ�к����϶������Ϊ_______________________�����ѧʽ��
��3����������õ��Լ�X��_________________��
��4���������õ��綾��HCN ��Һ����CN-�ķ�ˮ���봦��������ŷš���֪��������һ�־��п�����������ζ����ɫ�綾Һ�壬�ӷ���25��ʱ��Ka(HCN)=6.25��10-10��
��NaCN �ĵ���ʽΪ_________________����ӦCN�� +H2O![]() HCN+OH����25��ʱ��ƽ�ⳣ�� K= _________________��������ֵ��
HCN+OH����25��ʱ��ƽ�ⳣ�� K= _________________��������ֵ��
�ڴ�����CN-��ˮ�ķ����ǣ���һ������pH>10����NaClO��Һ�Ƚ�CN-������ȫ������ΪOCN-���ڶ������� pHΪ7.5~8.5����NaClO������ȫ������OCN��������N2�������Ρ�
��һ������ǿ���Ե���ҪĿ����__________________________________��
�ڶ�����Ӧ�����ӷ���ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ⱦ�ϵ���Ҫԭ�ϣ�ijͬѧ��ʵ����������ͼ��ʾװ����ȡ����������Ҫ�������£�

���ڴ��Թ��ォ2 mLŨ�����1.5 mLŨ�����ϣ�ҡ�ȣ���ȴ��50��60 �����£�Ȼ����μ���1 mL�����ߵα����Թܡ�
�ڰ�ͼ���Ӻ�װ�ã������Թܷ���60 ���ˮԡ�м���10���ӡ�
���������գ�
(1)ָ����ͼ�еĴ���__________��____________��
(2)�������м��뱽ʱ������μ��롱���ߵα����Թܡ���Ŀ����__________________________��
(3)��Ӧһ��ʱ����Һ���Է�Ϊ���㣬�ϲ���Ҫ������________(����������)���ѷ�Ӧ��Ļ��Һ����ʢ����ˮ���ձ�����裬���Կ���________(����ĸ)��
a��ˮ�����Ǻ������ʵ�������
b��ˮ���п�����ζ��Һ��
c���ձ��е�Һ̬�л���ֻ��������
d������ɫ����״Һ�帡��ˮ��
(4)Ϊ�˻�ô���������ʵ�鲽�裺��ˮϴ����Һ���ڽ���������ת�Ƶ�ʢ��__________���ձ���ϴ�ӡ���__________(����������)���з��룻��__________���ܸ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijdz��ɫ����XY�ͽ�̿��ϣ���ǿ�ȡ��������·�Ӧ:

��ͨ�뵪����Ȼ���ȼ���ƾ��ƣ�ʵ���й۲쵽����������ɫ������������Һ����ǡ����к�ɫ��δ���ɫ��ĩ�������ƶϲ���ȷ����
A. ��ʼͨ�뵪����Ŀ�����ž�װ���еĿ���
B. XY�뽹̿�ڸ����·�Ӧ����CO2��CO
C. X�������ƣ�Yһ������Ԫ��
D. ��ȼ�շ��������ŷŵ�β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о����ְ�����Ϣ���У�![]() (2��4-����-1-��ϩ)��
(2��4-����-1-��ϩ)��![]() (3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
(3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
A��2��4-����1��ϩ�ķ���ʽΪC9H18
B��2��4-����-1-��ϩ��3��7-����-1-��ϩ��Ϊͬϵ��
C������������Ϣ�ؾ���ʹ������Ȼ�̼��Һ��ɫ
D��1 mol�Ҳϵ�����Ϣ����1 mol Br2�ӳɣ�����ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ݻ�������ܱ������з���һ������NO2��������Ӧ2NO2(g) ![]() N2O4(g)����H<0�� �ڴﵽƽ������ֱ��ı��������������´ﵽƽ�����ʹƽ��������ƽ����Է���������С���� (����)
N2O4(g)����H<0�� �ڴﵽƽ������ֱ��ı��������������´ﵽƽ�����ʹƽ��������ƽ����Է���������С���� (����)
A��ͨ��N2 B��ͨ��NO2 C��ͨ��N2O4 D�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������÷�Һ©���������
A. ����ˮ B. �����屽 C. �Ҵ�����ˮ D. ������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ̬������AB�ᷢ�������������룬���뷽��ʽΪAB![]() A����B�����ڲ�ͬ�¶�����ƽ�ⳣ��ΪK(25 ��)��1.0��10��14��K(35 ��)��2.1��10��14��������������ȷ���� ( )��
A����B�����ڲ�ͬ�¶�����ƽ�ⳣ��ΪK(25 ��)��1.0��10��14��K(35 ��)��2.1��10��14��������������ȷ���� ( )��
A��c(A��)���¶����߶�����
B����35 ��ʱ��c(A��)��c(B��)
C��AB�ĵ���̶�(25 ��)��(35 ��)
D��AB�ĵ��������ȹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶������ݻ�������ܱ������У��������¿��淴Ӧ��C(s)+CO2(g)![]() 2CO(g)�����ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
2CO(g)�����ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
��2v(CO2)=v(CO) ��2n(CO2)=n(CO)
��2v��(C)=v��(CO) �ܻ��������ܶȱ��ֲ���
�ݻ�������ƽ��Ħ������
A. �� B. �ܢ� C. �٢� D. �ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com