


科目:高中化学 来源: 题型:
| A、浓NaOH溶液与浓CaCl2溶液混合:Ca2++2OH-=Ca(OH)2↓ |
| B、氯化铝溶液中滴加氨水生成沉淀:Al3++3OH-=Al(OH)3↓ |
| C、利用醋酸溶解含碳酸钙的水垢CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、NaHSO4溶液中滴加NaHCO3溶液:2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
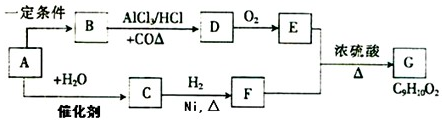
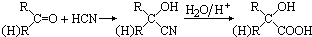 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: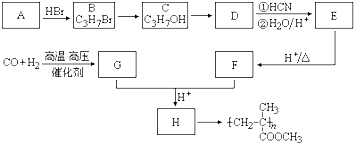
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 堆积模型 | 空间利用率 | 配位数 |
| bcp | 68% | 8 |
| hcp | 74% | 12 |
| ccp(fcc) | 74% | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
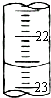 为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:
为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.00 | 21.01 |
| 2 | 25.00 | 2.00 | 24.00 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
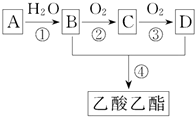 一股淡淡清香能给人心旷神怡的感觉,主要由香精、酒精和水构成的香水备受爱美人士的青睐.香精里面含有酯类物质,工业上以A为主要原料来合成乙酸乙酯,其合成路线如图所示.其中A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.又知
一股淡淡清香能给人心旷神怡的感觉,主要由香精、酒精和水构成的香水备受爱美人士的青睐.香精里面含有酯类物质,工业上以A为主要原料来合成乙酸乙酯,其合成路线如图所示.其中A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.又知| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 |
| B、某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
| C、向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- |
| D、先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸氢钠、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com