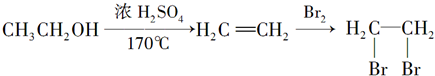已知M、R、T、X、Y、Z六种元素的原子序数依次递增的前四周期元素,M位于周期表的s区,其原子中电子层数和未成对电子数相同;R的基态原子中电子占据四个原子轨道(空间运动状态);T的基态原子的核外未成对电子数是同周期元素中最多的.Y是电负性最大的元素,Z是最外层电子数最少的元素中电子运动状态最多的元素.
请回答下列问题:(答题时,M、R、T、X、Y、Z用所对应的元素符号表示)
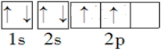
(1)T的核外电子排布图为
,Z的一价阳离子的价层电子排布式
.
(2)M和R形成的原子个数比为2:1的气态化合物为石油化工的基本原料,该物质中R原子的杂化方式为
该化合物中σ键和π键的个数比为
.
(3)T、X、Y与M形成的简单化合物的沸点由高到低的顺序为
(用化学式表示).
(4)XY
2的空间立体构型为
,M
2X与XY
2的分子的极性强弱的关系为
>
(用化学式表示).
电负性F:4.0 O:3.5 H:2.1 S:2.5 Be:1.5
从原子的电负性,中心原子的孤对电子等角度解释极性强弱的原因是
.
(5)查阅有关金属晶体资料得到
| 堆积模型 | 空间利用率 | 配位数 |
| bcp | 68% | 8 |
| hcp | 74% | 12 |
| ccp(fcc) | 74% | 12 |
Z的原子半径为a pm,N
A代表阿伏加德罗常数,则Z的晶体堆积模型为
,该金属单质的密度为
g/cm
3(计算结果保留两位有效数字).

 ,Z为Cu一价阳离子的价层电子排布式为1s22s22p63s23p63d10,
,Z为Cu一价阳离子的价层电子排布式为1s22s22p63s23p63d10, ;1s22s22p63s23p63d10;
;1s22s22p63s23p63d10;


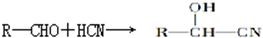 ,②R-CN
,②R-CN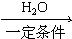 R-COOH
R-COOH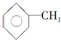 制备高分子化合物
制备高分子化合物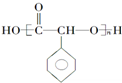 的合成路线流程图
的合成路线流程图