
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
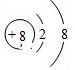 ,故答案为:
,故答案为: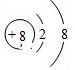 ;
;

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 相关信息 |
| X | 基态原子核外只有一种运动状态的电子 |
| Y | 用于自来水的消毒,单质黄绿色气体 |
| Z | 核素质量数为23,中子数为12,化合物焰色为黄色 |
| W | 常见的工业用量最大的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:T>W>Z>Y |
| B、W与T的单质可通过电解饱和的WT水溶液获得 |
| C、Z与W形成的两种化合物中化学键类型完全相同 |
| D、元素X、Z与T可形成多种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 堆积模型 | 空间利用率 | 配位数 |
| bcp | 68% | 8 |
| hcp | 74% | 12 |
| ccp(fcc) | 74% | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
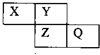 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A、X与Q的化合物中不含有共价键 |
| B、最高价氧化物对应水化物的酸性:Q比Z强 |
| C、氢化物稳定性:Y比Z强 |
| D、Q与Fe反应生成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
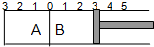 如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),
如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com