
【题目】t℃时,将0.200mol·L-1的某一元酸HA与0.200mol·L-1的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是

A. 所得溶液中:c(Na+)>c(A-)>c(HA)>c(OH-)
B. t℃时,水的离子积Kw=1.0×10-13
C. t℃时,一元酸HA的电离常数K=3.10×10-7
D. t℃时,0.100mol·L-1NaA溶液中A-的水解率为0.80%
【答案】D
【解析】
t℃时,将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,则起始时c(HA)=0.100mol/L,c(NaOH)=0.100mol/L,HA与NaOH发生反应NaOH+HA = NaA+H2O,反应恰好生成0.1mol/L的NaA,根据溶液中的守恒思想分析判断。
t℃时,将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,则起始时c(HA)=0.100mol/L,c(NaOH)=0.100mol/L,HA与NaOH发生反应NaOH+HA=NaA+H2O,反应恰好生成0.1mol/L的NaA,根据物料守恒,c(HA)+c(A-)=0.1mol/L,已知c(A-)=9.92×10-2mol/L,则c(HA)=0.1mol/L-9.92×10-2mol/L=8×10-4mol/L,c(Na+)=0.1mol/L,已知c(H+)=2.50×10-10mol/L,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),则c(OH-)=0.1mol/L+2.50×10-10mol/L-9.92×10-2mol/L>8×10-4mol/L。
A.所得溶液中,c(Na+)=0.1mol/L,c(A-)=9.92×10-2mol/L,c(HA)=8×10-4mol/L,c(OH-)>8×10-4mol/L,c(OH-)>c(HA),因此所得溶液中,粒子浓度大小关系为:c(Na+)>c(A-)>c(OH-)>c(HA),故A错误;
B.t℃时,溶液中c(H+)=2.50×10-10mol/L,c(OH-)>8×10-4mol/L,则水的离子积Kw=c(H+)c(OH-)>2.50×10-10×8×10-4=2×10-13>1.0×10-14,故B错误;
C.t℃时,一元酸HA的电离常数K=![]() =
=![]() =3.1×10-8,故C错误;
=3.1×10-8,故C错误;
D.t℃时,0.100mol/L的NaA溶液中,平衡时c(HA)=8×10-4mol/L,发生的水解反应为:A-+H2OHA+OH-,则水解率=![]() ×100%=0.80%,故D正确;
×100%=0.80%,故D正确;
答案选D。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】1mol氢气在氧气中完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是
A. 2H2(g)+O2(g)→2H2O(g)+241.8kJB. H2(g)+1/2O2(g)→H2O(g)+ 241.8 kJ
C. H2(g)+1/2O2(g)→H2O(g)-241.8 kJD. H2(g)+1/2O2(g)→H2O(l)+241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是两种气态烃组成的混合气体完全燃烧所得的CO2和H2O的物质的量(单位:mol)的变化关系。下列判断不正确的是:
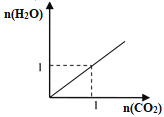
A. 一定含有甲烷
B. 可能含有乙烷
C. 可能含有乙炔
D. 若120℃不变,反应前后气体体积不一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成橡胶可以利用以下途径:


(1)C5H12同分异构体共有_____种,其中核磁共振H谱图只有1种的结构简式为________。
(2)下列有关上述的C5H8说法正确的是_____________。
A.所有的原子可能共平面 B.和溴水、溴的四氯化碳反应的现象不完全相同
C.所有C原子可能共平面 D.和溴的四氯化碳溶液反应生成产物最多有2种
(3)写出分子式C5H8属于炔烃的所有同分异构体的结构简式_____________________。
(4)写出下列反应的化学方程式(注明反应条件):
①C5H12→C5H10Cl2:_______________________________________________________。
②C5H10Cl2→C5H8:_____________________________________________________。
(5)以乙烷为原料可合成聚氯乙烯。请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:

(1)阴极反应式为___________。
(2)精炼过程中,AgNO3溶液的浓度将___________(填“增大”、“减小”或“不变”);原因是___________。
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下:

(3)定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=___________,(Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为___________。
(5)为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法___________。
(6)写出“还原”步骤中发生反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。

(1)用离子方程式解释AgNO3溶液pH<7的原因是____________________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42—(Ag2SO4可溶于硝酸);
ii. Ag2O能溶解在浓氨水中形成银氨溶液[Ag(NH2)2OH],而Ag2S和Ag均不能。
①设计并实施如下实验,证实沉淀中含有Ag2S,试剂1和试剂2分别是_________、________。

现象1中出现的现象是_______________________________。
②设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作补充完整。
实验操作 | 实验现象 | |
步骤i | 其少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀, ____________ | 没有沉淀出现 |
写出步骤i中反应的化学方程式:_________________________。
③经检验,沉淀中不含有Ag。
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a (a>0)。对AgNO3溶液中氧化S2—的物质进行推测:
假设1:0. 1 mol/L AgNO3溶液(pH=4)中的Ag+氧化了S2—;
假设2:0. 1 mol/L AgNO3溶液(pH=4)中的NO3—氧化了S2—
利用下图装置继续研究(已知:电压大小反映了物质氧化性与还原性强弱的差异;物质氧化性与还原性强弱的差异越大,电压越大)。

①将pH=4的0. 1 mol/L AgNO3溶液替换为_____溶液,记录电压为b(b>0)
②上述实验证实了氧化S2—的物质中一定包含了Ag+,其证据是_________实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com