
【题目】在混合导体透氧膜反应器中一步同时制备氨合成气(N2、H2)和液体燃料合成气(CO、H2),其工作原理如图所示,下列说法错误的是
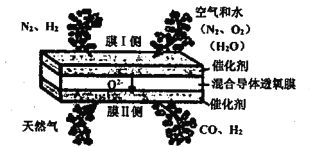
A. 膜I侧反应为: H2O+2e-=H2+O2- O2+4e-=2O2-
B. 膜II侧相当于原电池的负极
C. 膜II侧发生的反应为:CH4+O2--2e-=2H2+CO
D. 膜II侧每消耗1molCH4,膜I侧一定生成1mol H2
【答案】D
【解析】
A.膜I侧,H2O和O2在正极均发生还原反应,结合题图可写出其电极反应式为:H2O+2e-=H2+O2-、O2+4e-=2O2-,故A正确;
B.原电池中阴离子从正极向负极移动结合题图O2-的移动方向可知,膜I侧相当于原电池的正极,膜II侧相当于原电池的负极,故B正确;
C.膜II侧CH4发生氧化反应,其电极反应式为CH4+O2--2e-=2H2+CO,故C正确;
D.膜I侧发生的反应为:H2O+2e-=H2+O2-、O2+4e-=2O2-,膜II侧发生的反应为:CH4+O2--2e-=2H2+CO,膜II侧每消耗1molCH4,膜I侧生成小于1molH2,故D错误。
故选D。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图(部分严物未列出》。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C、E的化学式分别为A________C________E________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是___________。
A.C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4=FeSO4+H2↑
C.Cu+2H2SO4(浓)=CuSO4+ SO2↑+2H2O
D.FeO+ H2SO4=FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:_____________。
(4)若反应F+D→E转移电子数为3.01×1023,,则消耗D的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl固体 | 溶液颜色变浅 | FeCl3+3KSCN +3KCl平衡向逆反应方向移动 |
B | 向酸性高锰酸钾溶液中加入过量的FeI2固体 | 反应后溶液变黄 | 反应后溶液中存在大量Fe3+ |
C | 取3mL1 mol·L-1NaOH溶液,先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1FeCl3溶液 | 出现红褐色沉淀 | Mg(OH)2的Ksp比Fe(OH)3的Ksp大 |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 结合质子的能力:CO32->HCO3- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A2(?)+B2(?) 2AB(?),当温度和压强改变时,n(AB)的变化如下图,下列叙述正确的是

A. A2、B2及AB均为气体,ΔH<0
B. AB为气体,A2、B2至少有一种为非气体,ΔH<0
C. AB为气体,A2、B2有一种为非气体,ΔH>0
D. AB为固体,A2、B2有一种为非气体,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;2PCl3+O2=2POCl3。某化学学习小组用装置甲合成PCl3,并用装置乙采取PCl3氧化法制备POCl3

(1)氯元素在周期表中的位置是_____________
(2)H3PO3中所含元素原子半径由小到大的顺序为_____________
(3)能比较出氯的非金属性比磷的非金属性强的是______________
A.HCl酸性比H3PO4的强 B.HCl稳定性比PH3的强
C.HClO4的酸性比H3PO3的强 D.PCl3中P显正三价,C1显负一价
(4)图甲碱石灰的作用除了处理尾气外还有防止_____________进入烧瓶,影响产品纯度的作用
(5)图乙A装置中化学反应方程式是_____________
(6)POCl3水解的化学反应方程式为______________
(7)C中反应温度控制在60~65℃,其原因是____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如下图所示:

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__________________。
Fe在周期表中的位置为第________周期第Ⅷ族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是________________________。过程①溶解烧渣所需试剂中溶质的化学式为__________________。
反应②的化学方程式:______________________________________________________。
(3)反应③的目的是____________________________________。
气体Z的电子式:__________________。
写出反应④的离子方程式:______________________________________________________。
(4)将回收的G溶于少量水,所得溶液中所有离子的浓度由大到小依次是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入3 mol A和2 mol B发生如下反应:3A(g)+B(g)![]() xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积和温度不变,按起始物质的量A 0.6 mol、B 1.2 mol、C 1.6 mol充入容器达到平衡后,C的体积分数还为W%。则x的值( )
A. 只能为2 B. 只能为4 C. 可能为2,可能为4 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
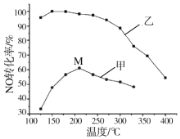
①工业上选择催化剂__________(填“甲”或“乙”)。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)。
(2)某研究小组对反应NO2+SO2![]() SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
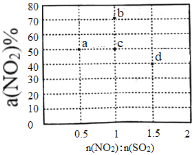
①如果将图中b点的平衡状态改变为c点的平衡状态,应采取的措施是________________。
②图中a、d两点对应的实验温度分别为T1和T2,则T1_______T2(填“>”、“=”或“<”)。
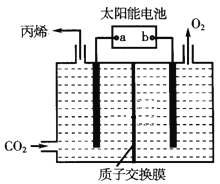
(3)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图所示。
①太阳能电池的正极为_____(填“a”或“b”)。
②生成丙烯的电极反应式是_____________________________。
③当生成标准状况下2.24L丙烯时,右侧溶液中质量减少____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com