
【题目】已知:PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;2PCl3+O2=2POCl3。某化学学习小组用装置甲合成PCl3,并用装置乙采取PCl3氧化法制备POCl3

(1)氯元素在周期表中的位置是_____________
(2)H3PO3中所含元素原子半径由小到大的顺序为_____________
(3)能比较出氯的非金属性比磷的非金属性强的是______________
A.HCl酸性比H3PO4的强 B.HCl稳定性比PH3的强
C.HClO4的酸性比H3PO3的强 D.PCl3中P显正三价,C1显负一价
(4)图甲碱石灰的作用除了处理尾气外还有防止_____________进入烧瓶,影响产品纯度的作用
(5)图乙A装置中化学反应方程式是_____________
(6)POCl3水解的化学反应方程式为______________
(7)C中反应温度控制在60~65℃,其原因是____________________________________________________
【答案】第三周期VIIA族 H<O<P BD 空气中的水蒸气 2H2O2 ![]() 2H2O+O2↑ POCl3+3H2O=H3PO4+3HCl 温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢
2H2O+O2↑ POCl3+3H2O=H3PO4+3HCl 温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢
【解析】
(1)氯是17号元素,原子核外有3个电子层,最外层有7个电子,故氯元素在周期表中的位置是第三周期VIIA族,故答案为:第三周期VIIA族。
(2)根据电子层数越多,原子的半径越大,若电子层数相同,则随着原子序数的增大,原子半径越小,故H3PO3中所含元素原子半径由小到大的顺序为H<O<P,故答案为:H<O<P。
(3)A.不能通过氢化物的酸性比较非金属性,故A错误;
B.元素的非金属性越强,对应氢化物的稳定性越强,HCl稳定性比PH3的强,可说明氯元素的非金属性比磷元素强,故B正确;
C.元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,H3PO3不是P元素的最高价含氧酸,不能作为判断的依据,不能说明氯元素的非金属性比磷元素强,故C错误;
D.PCl3中P显正三价,C1显负一价,说明氯对键合电子的吸引力更强,可说明氯元素的非金属性比磷元素强,故D正确。
故答案为:BD。
(4)PCl3易水解生成H3PO3和HCl,加入碱石灰,除了处理尾气外还有防止空气中的水蒸气进入烧瓶,故答案为:空气中的水蒸气。
(5)图乙A装置中H2O2在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
(6)POCl3中P为+5价,可水解生成磷酸和盐酸,反应的化学方程式为:POCl3+3H2O=H3PO4+3HCl,故答案为:POCl3+3H2O=H3PO4+3HCl。
(7)由题可知PCl3的熔点为-112℃,沸点为75.5℃,C中反应温度控制在60~65℃,如果温度过高,PCl3会大量挥发,从而导致产量降低;如果温度过低,则反应速率会变慢,故答案为:温度过高,PCl3会大量挥发,导致产量降低;温度过低,反应速率会变慢。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A. S![]() SO2
SO2![]() BaSO4
BaSO4
B. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3(aq)
Na2SiO3(aq)
C. MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
D. N2![]() NO2
NO2![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铝及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题;
(1)硅位于元素周期表的第______周期______族。Pb比Si的原子半径______(填“大”或“小”)
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________mol电子。
Ⅱ.元素铬(Cr)在自然界主要以+3价和+6价存在。工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:

(1)水浸I要获得浸出液的操作是______。
(2)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀,则pH为______[c(Cr3+)降至10-5 mol/L可认为完全沉淀]。
(3)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=C2O72-+H2O)。
阳极的电极反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在混合导体透氧膜反应器中一步同时制备氨合成气(N2、H2)和液体燃料合成气(CO、H2),其工作原理如图所示,下列说法错误的是
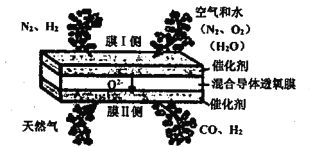
A. 膜I侧反应为: H2O+2e-=H2+O2- O2+4e-=2O2-
B. 膜II侧相当于原电池的负极
C. 膜II侧发生的反应为:CH4+O2--2e-=2H2+CO
D. 膜II侧每消耗1molCH4,膜I侧一定生成1mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验室制备氯气的装置(如下),回答下列问题;

(1)仪器A 和 B名称___________ ;____________
(2)写出B中发生反应的离子方程式_____________________________________
(3)装置C的作用__________________________________________
(4)装置D的作用________________________________________________
(5)检验E中氯气已经收集满的方法_________________________________________
(6)写出F中发生的反应方程式______________________________________________
(7)每生成0.5mol氯气转移________________个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应的解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A |
2 mL 0.2mol L-1 H2C2O4(草酸)溶液 | 右侧试管中溶液紫色褪去慢,推知反应物浓度越大,反应速率越小 |
B | 分别向盛有等量煤油、无水乙醇的两烧杯中加入大小相等的金属钠,对比观察现象 | 乙醇分子中羟基上的氢原子活泼 |
C | 分别向盛有动物油、石蜡的两烧杯中加入足量烧碱溶液,充分加热,冷却 | 动物油、石蜡均能发生皂化反应 |
D | 将电石与食盐水反应生成的气体,通入酸性高锰酸钾溶液中,观察溶液颜色变化 | 由溶液紫色褪去可知乙炔能发生氧化反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.

(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com