
【题目】I.铝及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题;
(1)硅位于元素周期表的第______周期______族。Pb比Si的原子半径______(填“大”或“小”)
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________mol电子。
Ⅱ.元素铬(Cr)在自然界主要以+3价和+6价存在。工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:

(1)水浸I要获得浸出液的操作是______。
(2)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀,则pH为______[c(Cr3+)降至10-5 mol/L可认为完全沉淀]。
(3)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=C2O72-+H2O)。
阳极的电极反应式为______。

【答案】三 ⅣA 大 弱 充电 5 过滤 5(或≥5) 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O)
【解析】
I.(1)根据硅的原子结构判断其在周期表的位置,根据原子核外电子层数越多,原子半径越大判断;
(2)硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成难电离物质或弱电解质醋酸铅,促进硫酸铅溶解;
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,A是原电池,则逆过程是电解池,所以中工作“B”为充电;
2PbSO4+2H2O,A是原电池,则逆过程是电解池,所以中工作“B”为充电;
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色,说明生成高锰酸根离子,高锰酸根中锰元素为+7价,由此分析解答。
II.(1)由流程可知得到难溶性的固体和液体,该操作为过滤;
(2)根据溶度积常数计算;
(3)阳极发生氧化反应,由水中的氢氧根离子放电,氢离子与CrO42-结合得Cr2O72-;
I.(1)Si是第三周期第IVA的元素,铅与碳是同族元素,且比碳多4个电子层,由于原子核外电子层数越多,原子半径越大,所以原子半径Pb>Si;
(2)硫酸铅在水溶液里存在沉淀溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成难电离物质即产生弱电解质醋酸铅,促进硫酸铅溶解,说明(CH3COO)2Pb是弱电解质;
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,A是原电池,Pb是负极,PbO2是正极,则其逆过程是电解池,所以在工作“B”为充电过程;
2PbSO4+2H2O,A是原电池,Pb是负极,PbO2是正极,则其逆过程是电解池,所以在工作“B”为充电过程;
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色,说明生成MnO4-离子,在MnO4-中锰元素为+7价,即+2价的锰被氧化成+7价,所以每反应1molMn(NO3)2,转移5mol电子;
II.(1)由流程可知水浸I是分离难溶性的固体与溶液的操作方法,该操作为过滤;
(2)Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1×10-32,若c(Cr3+)=10-5mol/L,此时c3(OH-)=![]() =10-27,所以c(OH-)=10-9mol/L,则c(H+)=
=10-27,所以c(OH-)=10-9mol/L,则c(H+)=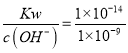 =10-5mol/L,所以溶液的pH=5;
=10-5mol/L,所以溶液的pH=5;
(3)①阳极发生氧化反应,由水中的氢氧根离子放电,电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O),氢离子与CrO42-结合得Cr2O72-。


科目:高中化学 来源: 题型:
【题目】某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期VA族。D、E、H均为难溶于水的白色固体:化合物C、E均含A元素。其余物质均为中学化学中常见物质。
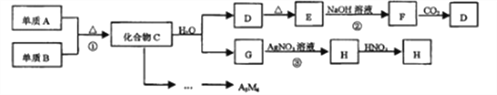
请回答:
(1)写出H的化学式:________________。
(2)化合物A3M4中含有的化学键类型为:________________。
(3)写出反应②的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-282.8kJ·mol-1
现有CO、H2、CO2组成的混合气体67.2L(标准状况),经完全燃烧后放出的总热量为710.0kJ,并生成18g液态水,则燃烧前混合气体中CO的体积分数为( )
A. 80% B. 50% C. 60% D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
C. 制硝酸:N2、H2 ![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3 ![]() 浓HNO3
浓HNO3
D. 海带![]() 海带灰
海带灰![]()
![]() I2(aq)
I2(aq)![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A2(?)+B2(?) 2AB(?),当温度和压强改变时,n(AB)的变化如下图,下列叙述正确的是

A. A2、B2及AB均为气体,ΔH<0
B. AB为气体,A2、B2至少有一种为非气体,ΔH<0
C. AB为气体,A2、B2有一种为非气体,ΔH>0
D. AB为固体,A2、B2有一种为非气体,ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含镍(Ni)质量分数约20%废料,主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
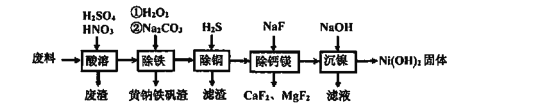
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成。写出金属镍溶解的化学方程式______________________
(2)“除铁”时H2O2的作用是________________,为了证明添加的H2O2已足量,应选择的试剂是_______________ (填序号:“①铁氰化钾K3[Fe(CN)6]”或“②硫氰化钾KSCN”)溶液.黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:____:2:6
(3)“除铜”时,反应的离子方程式为________________
(4)已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF“除钙镁”后,所得滤液中![]() ________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
(5)100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,则镍回收率为______________(保留1位小数)
(6)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;2PCl3+O2=2POCl3。某化学学习小组用装置甲合成PCl3,并用装置乙采取PCl3氧化法制备POCl3

(1)氯元素在周期表中的位置是_____________
(2)H3PO3中所含元素原子半径由小到大的顺序为_____________
(3)能比较出氯的非金属性比磷的非金属性强的是______________
A.HCl酸性比H3PO4的强 B.HCl稳定性比PH3的强
C.HClO4的酸性比H3PO3的强 D.PCl3中P显正三价,C1显负一价
(4)图甲碱石灰的作用除了处理尾气外还有防止_____________进入烧瓶,影响产品纯度的作用
(5)图乙A装置中化学反应方程式是_____________
(6)POCl3水解的化学反应方程式为______________
(7)C中反应温度控制在60~65℃,其原因是____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的化学反应,能量关系如下图,下列叙述正确的是( )

A.该反应为吸热反应
B.1 mol锌的能量高于1 mol H2所含的能量
C.若将该反应设计成原电池,锌为负极
D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如图所示。下列说法正确的是( )
随n(NaOH)的变化如图所示。下列说法正确的是( )
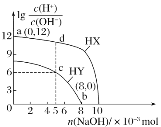
A. HX为弱酸,HY为强酸
B. 水的电离程度:d>c>b
C. c点对应的溶液中:c(Y-)>c(Na+)>c(H+)>c(OH-)
D. 若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com