
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如图所示。下列说法正确的是( )
随n(NaOH)的变化如图所示。下列说法正确的是( )
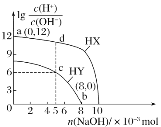
A. HX为弱酸,HY为强酸
B. 水的电离程度:d>c>b
C. c点对应的溶液中:c(Y-)>c(Na+)>c(H+)>c(OH-)
D. 若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
【答案】C
【解析】
A.lg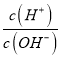 越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg
越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg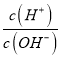 =12,说明c(H+)=0.1mol/L=c(HX),所以HX为强酸,其酸性强于HY,加入氢氧化钠物质的量10×10-3mol,酸HX和氢氧化钠溶液恰好反应,lg
=12,说明c(H+)=0.1mol/L=c(HX),所以HX为强酸,其酸性强于HY,加入氢氧化钠物质的量10×10-3mol,酸HX和氢氧化钠溶液恰好反应,lg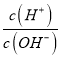 =1,c(H+)=c(OH-),溶液呈中性,故HX为强酸,HY为弱酸,故A错误;B.d点是强酸HX的溶液中滴加NaOH溶液恰好将HX反应一半、剩余一半,故水的电离被强酸抑制;c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg
=1,c(H+)=c(OH-),溶液呈中性,故HX为强酸,HY为弱酸,故A错误;B.d点是强酸HX的溶液中滴加NaOH溶液恰好将HX反应一半、剩余一半,故水的电离被强酸抑制;c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg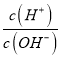 =6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,水的电离也被抑制;而在b点,加入的氢氧化钠的物质的量为8×10-3mol,所得的溶液为大量的NaY和少量的HY混合溶液,而lg
=6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,水的电离也被抑制;而在b点,加入的氢氧化钠的物质的量为8×10-3mol,所得的溶液为大量的NaY和少量的HY混合溶液,而lg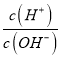 =0,离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)=10-7,溶液显中性,即HY的电离程度等于Y-的水解程度,水的电离没有被促进也没有被抑制,故水的电离程度d<c<b,故B错误;C.c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg
=0,离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)=10-7,溶液显中性,即HY的电离程度等于Y-的水解程度,水的电离没有被促进也没有被抑制,故水的电离程度d<c<b,故B错误;C.c点加入的氢氧化钠的物质的量为5×10-3mol,所得的溶液为NaY和HY的等浓度的混合溶液,而lg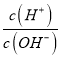 =6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,故c(Y-)>C(Na+)>c(HY)>c(H+)>c(OH-),故C正确;D.若将c点与d点的溶液全部混合,所得溶液等同NaX、HY等物质的量的混合液,其中X-不水解,HY部分电离,则溶液中离子浓度大小为c(Na+)=c(X-)>c(H+)>c(Y-)>c(OH-),故D错误;答案为C。
=6,水的离子积Kw=c(H+)c(OH-)=10-14,故可知c(H+)2=10-8,则c(H+)=10-4mol/L,溶液显酸性,即HY的电离大于Y-的水解,故c(Y-)>C(Na+)>c(HY)>c(H+)>c(OH-),故C正确;D.若将c点与d点的溶液全部混合,所得溶液等同NaX、HY等物质的量的混合液,其中X-不水解,HY部分电离,则溶液中离子浓度大小为c(Na+)=c(X-)>c(H+)>c(Y-)>c(OH-),故D错误;答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.铝及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题;
(1)硅位于元素周期表的第______周期______族。Pb比Si的原子半径______(填“大”或“小”)
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
2PbSO4+2H2O,其中工作“B”为______(填“放电”或“充电”)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________mol电子。
Ⅱ.元素铬(Cr)在自然界主要以+3价和+6价存在。工业上利用铬铁矿(FeO·Cr2O3)冶炼铬的工艺流程如图所示:

(1)水浸I要获得浸出液的操作是______。
(2)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀,则pH为______[c(Cr3+)降至10-5 mol/L可认为完全沉淀]。
(3)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=C2O72-+H2O)。
阳极的电极反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )

A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采用吸收-电解联合法除去天然气中的H2S气体,并转化为可回收利用的单质硫,其装置如下图所示。通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率即可保证装置中反应的连续性。下列说法正确的是

A. 与电源a端相连的碳棒为阳极,气体A为O2
B. 与电源b端相连的碳棒上电极反应为:2H2O+2e-=2OH-+H2↑
C. 通电过程中,右池溶液中的OH-通过阴离子膜进入左池
D. 在通电前后,右池中的c(NaOH)与c(Na2S)之比基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
资料卡片 | ||
物质 | 熔点 | 沸点 |
SiCl4 | -70℃ | 57.6℃ |
TiCl4 | -25℃ | 136.5℃ |
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II. 将SiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV. TiO2·xH 2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是________。II中所采取的操作名称是_______。
②III中反应的化学方程式是____________________________________________。
③如IV在实验室完成,应将TiO2·xH2O放在________(填仪器编号)中加热。

(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是________________。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO![]() )越大,净水效果越好,这是因为______________。
)越大,净水效果越好,这是因为______________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++______=CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+ 3×10-7mo1,是否达到了排放标准__(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12 与CN-的物质的量之比为5︰2,则该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.

(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关事实,与水解反应无关的是
A. 热的纯碱溶液用于清洗油污
B. 氯化铁溶液腐蚀铜板
C. 加热蒸干氯化铁溶液,不能得到氯化铁晶体
D. 用TiCl4和大量水反应,同时加热制备TiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com