
����Ŀ������������ȼ�ϵ��������������(Westinghouse)��˾���ƿ����ģ����Թ��������һ������Ϊ����ʣ����ֹ��������ڸ���������������(O2-)�����ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж�缫a��b��������缫��Ӧ�������ж���ȷ����
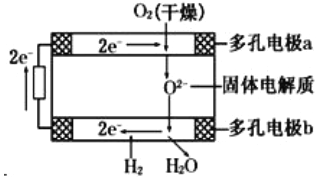
A����O2�ŵ��a��Ϊ��صĸ���
B��O2-�����ص�����
C��b����Ӧ�ĵ缫��ӦΪ2H2- 4e-+2O2-=2H2O
D��a����Ӧ�ĵ缫��ӦΪO2+2H2O+4e-=4OH-

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������AԪ�صĵ����ǿ�������Ҫ�ɷ֣�Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ�DԪ�صļ۵������������������һ�룬C��Bͬ���壬A��Fͬ���壬D��Eͬ�塣�ش��������⣺
��1��A��B��C�ĵ�һ�������ɴ�С��˳��Ϊ_______________����Ԫ�ط��ű�ʾ����
��2��B��C�γɵĶ�Ԫ�������У����ڷǼ��Է��ӵ���________���ѧʽ�����÷�������ԭ�ӵ��ӻ��������Ϊ_____________��
��3��A��C�ֱ��γɵij����ĺ���������У�����ԭ�ӵļ۲���Ӷ���Ϊ4������______���ѧʽ����ͬ���������ƽ�������ε�����________________��
��4��Dn+��Br-��C����ۺ��������A�ļ��⻯�ﰴ1:1:1:5�γ�ij���������������Һ�еμ�AgNO3��Һ��������ɫ�������μ�BaCl2��Һ���������������е�����Ϊ___________��nֵΪ__________��Dn+�Ļ�̬�����Ų�ʽΪ____________��
��5������EB����Ľṹ��ͼ��ʾ���侧���߳�Ϊapm����ʽ��ʾEB������ܶ�Ϊ__________g��cm-3�����ؼ�������������٤��������ֵΪNA�����˹��Ʊ���EB�����г�����ȱ�ݣ�һ��E2+��ȱ����������E2+������E3+��ȡ�������������Գʵ����ԣ�����������E��B�ı�ֵȴ�����˱仯����֪ij��������Ʒ���E0.96B���þ�����E3+��E2+�����Ӹ���֮��Ϊ_____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ��ʳ�εķ�ʽ�ж��֣�����Ҫ���Ǻ�ˮɹ�Ρ�ͨ����ˮ��ɹ�õ��Ĵ��γ�NaCl�⣬������MgCl2��CaCl2��Na2SO4�Լ���ɳ�����ʣ��������Ʊ����ε�ʵ�����̣��Լ��Ի�ѧʽ��ʾ��
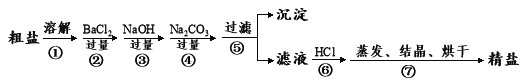
��1��BaCl2��NaOH��Na2CO3�ļ���˳���뱣֤___________��____________��
��2���ܽ⡢���ˡ����������ж�ʹ�õ��IJ���������_______ _________������ʱ��������������______________________
��3�������ݲ���֮��õ��ij����ijɷ�Ϊ��________________________
��4���Ƶõľ����в�С�Ļ���������ؾ��壬�õ�����ƽ��ȡ8.00g��Ʒ����ˮ������Һ�м���������������Һ���������ij������ˡ�ϴ�ӡ�������Ƶ�������Ϊ14.35g�������Ʒ���Ȼ��Ƶ���������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Թ��С��ſڴƻơ������ۻ���ҩ��֮˵���ۻ���As4S4���ʹƻ���As2S3������ȡ�����Ҫ����ԭ�ϣ���������Ȼ���й��������ڶ��������滭���ϣ����п�������ЧҲ������ҩ�������������������գ�
��1�� ��Ԫ����+2��+3���ֳ�����̬��As2S3��SnCl2�������з�Ӧת��ΪAs4S4��SnCl4���ų�H2S���壬д���÷�Ӧ�Ļ�ѧ����ʽ_____________________��
��2�� ������Ӧ�е���������___________������������___________����Ӧ������H2S�������____________���ա�
��3��As2S3��HNO3�����·�Ӧ��As2S3+10H++ 10NO3��=2H3AsO4+3S+10NO2��+ 2H2O��������1mol H3AsO4����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ___________�������÷�Ӧ��Ƴ�һԭ��أ���NO2Ӧ����___________�����������������������������ݳ���
��4������Ӧ����NO2��11.2LO2����״������Ϻ���ˮ����ȫ��ת����ŨHNO3��Ȼ���������̼��Ӧ��д��̼��Ũ���ᷴӦ�Ļ�ѧ����ʽ__________________����������CO2����___________��ѡ��������
A��С��0.5mol B������0.5mol C������0.5mol D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㡢�⡢�̡������������ʳ���к��ḻ��
A. ����ά���� B. ������ C. ���� D. ֬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ʱȽϣ���ȷ���ǣ� ��
A. ���ԣ�H2SO4��HClO B. ��̬�⻯���ȶ��ԣ�HCl��H2S
C. ���Ӱ뾶��Na+��F- D. ���ԣ�NaOH��KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����HC1��AlCl3�����Һ����μ���NaOH��Һ�����ɳ���������NaOH��Һ�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ����������

A��M���Ӧ����Һ�У�K+��Fe2+��NO3-��SO42-
B��N���Ӧ����Һ�У�K+��NH4+��HCO3-��Cl��
C��S���Ӧ����Һ�У�Na+��Ag+��SO42-��NO3-
D��R���Ӧ����Һ�У�Na+��SO42-��NO3-��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ľ�ѩ����������·�������㣬���д���أ�CH3COOK������ѩЧ���Ϻõ���ѩ�������й��ڴ����˵����ȷ����
A. 1 mol CH3COOK������Ϊ98 g��mol��1
B. CH3COOK��Ħ����������������Է�������
C. һ��CH3COOK��������ԼΪ![]() g
g
D. ����6.02��1023��̼ԭ�ӵ�CH3COOK�����ʵ���Ϊ1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��ԭ��������������Aԭ�Ӻ�����������A��Cͬ���壬A��B�γɵĻ�������ˮ�гʼ��ԣ�����D�ڵ���E�п�ȼ�ղ�����ɫ�������ش��������⣺
(1)��B�⣬����Ԫ�صĵ縺�ԴӴ�С����Ϊ ��(��Ԫ�ط��ű�ʾ)
(2)B���⻯����ͬ��������������������γɵ��⻯��е��ɸߵ��͵�����˳���� ���û�ѧʽ��ʾ),ԭ���� ��
(3)A��D�γɵĻ����������ԭ�ӵ��ӻ�����Ϊ ��A��B�γɵĻ�����BA5�д��ڵĻ�ѧ������Ϊ ��
(4)����D��һ�ֺ�����ɱ�ʾΪH3DO3�����Ƕ�Ԫ���ᣬ��д����������������������Һ��Ӧ�����ӷ���ʽ____________��
(5)C ��һ��������ľ����ṹ��ͼ��ʾ,��������a=0.566 nm��������Cԭ�ӵ���λ��Ϊ ���˾�����ܶ�(g��cm��3)Ϊ (ֻ��ʽ������)��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com