
可逆反应A(g)+3B(g)  2C(g);△H= -QkJ/mol。有甲、乙两个容积相同且固定不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=2Q2。下列叙述正确的是
2C(g);△H= -QkJ/mol。有甲、乙两个容积相同且固定不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=2Q2。下列叙述正确的是
A.甲中A的转化率为75%
B.Q1 + Q2 < Q
C.达到平衡后,再向乙中加入1/3 molA、1 molB、4/3 molC,平衡向正反应方向移动
D.乙中热化学方程式为2C(g) A(g)+3B(g);△H= + Q2 kJ/mol
A(g)+3B(g);△H= + Q2 kJ/mol
科目:高中化学 来源: 题型:
把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A.3.18g B.2.12g C.4.22g D.5.28g
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近合成出了第112号元素,其原子的质量数为277,这是迄今已知元素中最重的原子。关于该元素的叙述正确的是( )
A.其原子核内中子数和质子数都是112 B.其原子核内中子数为165,核外电子数为165
C.其原子质量是12C原子质量的277倍 D.其原子质量与12C原子质量之比为277∶12
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和。下列说法不正确的是( )
A.B元素形成的气态氢化物分子的空间结构是三角锥形
B.气态氢化物的稳定性C>E的原因是C分子间存在氢键
C.EC2是一种大气污染物
D.A的单质均能溶于热的B或E的最高价氧化物的水化物的浓溶液中
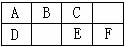
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.贝采里乌斯提出了有机化学概念,维勒打破了无机物和有机物的界限,范特霍夫提出了有机化合物的三维结构。
B.同位素示踪法、比色分析法都是科学家经常使用的研究化学反应历程的手段之一。
C.降低能耗是重要的节能措施,可以通过合理设计工艺路线,优化工艺条件和研制性能优良的催化剂等来实现。
D.科学家将蛋白质的结构层次分为四级进行研究,蛋白质的二级结构主要依靠肽链中-NH-上的氢原子与羰基上的氧原子形成氢键而实现的。
查看答案和解析>>
科目:高中化学 来源: 题型:
X是一种抗菌药,用于治疗急、慢性溃疡性结肠炎,其结构简式如右图。
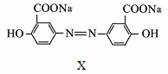
以有机物A为原料合成X的路线如下:
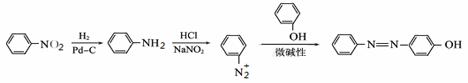
已知:
回答下列问题:
(1)写出A中含有的官能团的名称________。
(2)写出下列反应的反应类型:③____________;④____________。
(3)写出E的结构简式__________。
(4)写出第②步反应的化学方程式__________。
(5)在第一步反应中可能会生成一种高聚物的副产物,写出该副产物的结构简式____________。
(6)B有多种同分异构体,写出同时符合下列条件B的所有同分异构体结构简式__________。
① 能发生银镜反应;② 一定条件下与NaOH溶液完全反应,需消耗2 mol NaOH; ③ 分子结构中不含甲基;④ 苯环上有2种不同化学环境的氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是 ( )
A.1 mol CO2的质量是44g/mol B.铝离子的摩尔质量是27g
C. H2O的摩尔质量是18g/mol D.H2的相对分子质量是2g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(S) +2B(g)  4C (g) △H >0 达到平衡时,若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
A. 增加A的物质的量 B. 加压 C. 升温 D. 使用催化剂
(2)关于锌铜—稀硫酸原电池的叙述,错误的是
A、氢离子在铜表面被还原,产生气泡 B、电流从锌片经导线流向铜片
C、电子从锌片经导线流向铜片 D、锌是负极,其质量逐渐减小
 (3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g)
(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g)  CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
⑴所需浓H2SO4的体积为
⑵如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒,实验中还需要用到的仪器有
⑶若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容
②定容时俯视刻度线
⑷若定 容时液面高于刻度线应采取的措施是
容时液面高于刻度线应采取的措施是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com