
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物: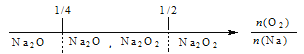
B. 铁在Cl2中燃烧,铁的氧化产物:![]()
C. NH3与Cl2反应,反应产物:
D. FeBr2溶液中通入Cl2,铁元素存在形式:
【答案】C
【解析】
试题A.钠在氧气中燃烧,无论相对量的多少,产生的都是Na2O2,错误;B.铁在Cl2中燃烧,无论相对量的多少,产生的都是FeCl3,错误;C.NH3与Cl2反应,当氨气少量时,发生反应:2NH3+3Cl2=6HCl+N2,当氨气过量时发生的总反应是: NH3+3Cl2=6NH4Cl+N2,若介于2:3和8:3之间则产物是NH4Cl、N2、HCl,正确;D.FeBr2溶液中通入Cl2,由于还原性:Fe2+>Br-,首先发生反应:Cl2+2Fe2+=2Fe3++2Cl-,若氯气过量,则发生反应:2Cl2+2Fe2++4Br-=2Fe3++2Cl-+2Br2,所以上述数轴表示不符合反应的先后顺序,错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
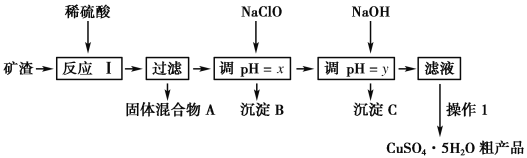
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢)②H2O2+H2=2H2O(快),T℃时测得有关实验数据如下:
序号 | c(NO)/molL-1 | c(H2)/molL-1 | 速率/molL-1min-1 |
Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
下列说法错误的是
A. 整个反应速度由第①步反应决定
B. 该反应速率表达式:v=5000c2(NO)·c(H2)
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g) △H=-664kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500 ℃,10 mol SO2和5 mol O2反应
乙:500 ℃,V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:450 ℃,8 mol SO2和5 mol O2反应
丁:500 ℃,8 mol SO2和5 mol O2反应
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁
C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)硼、铟与镓同是ⅢA族元素,写出镓元素基态原子的价电子排布图:_______________。B3N3H6可用来制造具有耐油、耐高温性能的特殊材料,它的一种等电子体的分子式为_________,B3N3H6分子中N、B原子的杂化方式分别为_________、______。
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜铟硒薄膜电池等。其中元素As、S、P、Ga的电负性由小到大的顺序为:______________________________________________。
(3)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。该离子中含有化学键的类型有____________________(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
(4)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M, M的晶胞结构如图乙所示。写出该反应的离子方程式:________________________________________________。
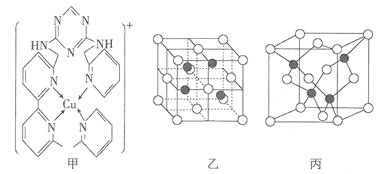
(5)已知由砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其晶胞结构如图丙所示,请写出化合物A的化学式_____________。设化合物A的晶胞边长为![]() pm,则每立方厘米该晶体中所含砷元素的质量为____________________g(NA表示阿伏加德罗常数的值)。
pm,则每立方厘米该晶体中所含砷元素的质量为____________________g(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氢氧化铝能与酸反应 | 用作抗酸药 |
C. | 明矾易溶于水 | 可作净水剂 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L。下列判断错误的是
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2min内A的平均反应速率为0.3 mol·L-1·min-1
D. 若混合气体的密度不变,也不能说明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为___________;常温下丁溶液pH___7(填“>”“<”或“=”),用离子方程式解释原因____________;
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。回答下列问题:
①A在周期表中位置为___________;
②向丁的水溶液中滴入紫色石蕊试液,现象为_____________________;
③写出加热条件下上述生成丙的化学方程式__________________;
④向MCl2的溶液中通入丁,生成白色MCl沉淀,写出该反应的离子方程式__________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com